
| A. | Na2CO3和H2SO4 | B. | NaAlO2和HCl | C. | Na2CO3和Ca(OH)2 | D. | KAl(SO4)2和NaOH |
分析 下列各组稀溶液,只用试管和胶头滴管无法鉴别,说明两种溶液混合时无论哪种溶液过量都产生相同的实验现象相同,据此分析解答.
解答 解:A.Na2CO3中滴加H2SO4,反应方程式为CO32-+H+=HCO3-、HCO3-+H+=CO2↑+H2O,如果硫酸中加入碳酸钠溶液,反应离子方程式为CO32-+2H+=CO2↑+H2O,所以反应现象不同,可以只用试管和胶头滴管鉴别,故A不选;
B.NaAlO2中加入HCl,离子反应方程式为H2O+AlO2-+H+=Al(OH)3↓、Al(OH)3+3H+=Al3++3H2O,HCl中NaAlO2发生的离子反应方程式为4H++AlO2-=Al3++H2O,所以反应现象不同,可以只用试管和胶头滴管鉴别,故B不选;
C.Na2CO3和Ca(OH)2混合,无论哪种物质过量都发生相同的离子反应CO32-+Ca2+=CaCO3↓,实验现象相同,无法只用试管和胶头滴管鉴别,故C选;
D.KAl(SO4)2中滴加NaOH,离子反应方程式为Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O,NaOH中滴加硫酸铝钾溶液,发生的离子反应为4OH-+Al3+=AlO2-+2H2O,反应现象不同,可以只用试管和胶头滴管鉴别,故D不选;
故选C.
点评 本题考查物质鉴别,为高频考点,明确物质差异性是解本题关键,注意:有些化学反应与反应物的量有关、与反应条件有关、与反应物浓度有关,题目难度不大.


科目:高中化学 来源: 题型:解答题
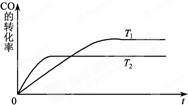 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g).分析该反应并回答下列问题:
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g).分析该反应并回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 直径介于1nm~100nm之间的微粒称为胶体 | |
| B. | 制备Fe(OH)3胶体的方法是将饱和FeCl3溶液加热煮沸 | |
| C. | 胶体与浊液的本质区别是其稳定性,胶体属于介稳体系 | |
| D. | 利用丁达尔效应可以区分溶液和胶体溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30g/mol | B. | 60g/mol | C. | 90g/mol | D. | 120g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com