
| A.H2Te > H2Se > H2S > H2O | B.KCl>NaCl>LiCl>HCl |
| C.Sr>Ba>Ca>Be | D.金刚石>SiC>晶体硅 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:填空题
 、—CH3、
、—CH3、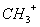 都是重要的有机反应中间体,有关它们的说法正确的是_________________
都是重要的有机反应中间体,有关它们的说法正确的是_________________| A.它们均由甲烷去掉一个氢原子所得 |
| B.它们互为等电子体,碳原子均采取sp2杂化 |
| C.CH与NH3、H3O+互为等电子体,几何构型均为三角锥形 |
D.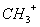 中的碳原子采取sp2杂化,所有原子均共面 中的碳原子采取sp2杂化,所有原子均共面 |
 和一个
和一个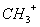 结合均可得到CH3CH3
结合均可得到CH3CH3查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
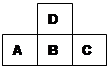
| A.C的单质可跟B的氢化物的水溶液反应 |
| B.原子半径A>B>C |
| C.D的氢化物比B的氢化物稳定 |
| D.A的高价氧化物对应水化物比B的高价氧化物对应水化物的酸性强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Cl ③白磷 ④氯气 ⑤红磷
Cl ③白磷 ④氯气 ⑤红磷  Cl ⑦正丁烷 ⑧异丁烷
Cl ⑦正丁烷 ⑧异丁烷查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.H2S、H2O、HF的稳定性依次增强 |
| B.Na+、Mg2+、Al3+的氧化性依次减弱 |
| C.H2SiO3、H2CO3、H2SO4的酸性依次增强 |
| D.KOH、NaOH、Mg(OH)2的碱性依次减弱 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素编号 | 元素性质或原子结构 |
| T | M层上有2对成对电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Ge的电负性为1.8,则其是典型的非金属 |
| B.L层不含s能级,M层存在3f能级 |
| C.焰火是焰色反应,都是电子由基态跃迁到激发态的结果 |
| D.在电子云示意图中,小黑点是电子在原子核外出现的概率密度的形象描述 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
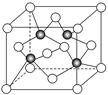
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
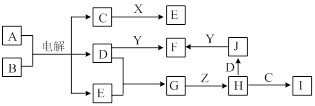
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com