
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A.标准状况下,22.4 L的CCl4中C—Cl键数为为4NA
B.常温下,1 L 0.1molL﹣1的![]() 溶液中氮原子数为0.2 NA
溶液中氮原子数为0.2 NA
C.在反应KIO3+6HI=KI+3I2+3H2O中,每生成3molI2转移的电子数为6 NA
D.0.1mol乙酸与0.1mol乙醇反应生成乙酸乙酯的分子数为0.1NA
科目:高中化学 来源: 题型:
【题目】(15分)CoCl2·6H2O是一种饲料营养强化剂。以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种新工艺流程如图:

已知:
① 钴与盐酸反应的化学方程式为:Co+2HCl→CoCl2+H2↑
② CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110 ~120℃时,失去结晶水变成有毒的无水氯化钴。
③ 部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
开始沉淀 | 2.3 | 7.5 | 7.6 | 3.4 |
完全沉淀 | 4.1 | 9.7 | 9.2 | 5.2 |
(1)在上述工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点为_______________________。
(2)加入碳酸钠调节pH至a,a的范围是________________________。
(3)操作Ⅰ包含3个实验基本操作,它们依次是____________________和过滤。
(4)制得的CoCl2·6H2O在烘干时需减压烘干的原因是_____________________。
(5)为测定产品中CoCl2·6H2O含量,某同学将一定量的样品溶于水,再向其中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称量其质量。通过计算发现产品中CoCl2·6H2O的质量分数大于100%,其原因可能是____________ ___。
(6)在实验室,为了从上述产品中获得纯净的CoCl2·6H2O,通常先将产品溶解在乙醚中,除去不溶性杂质后,再进行 _操作。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将晶体X加热分解,可得A、B、D、E、F和水六种产物,其中A、B、D都是中学化学中常见的氧化物,气体E是单质F所含元素的氢化物。
(1)A能溶于强酸、强碱,写出A与强碱溶液反应的离子方程式: 。
(2)B、D都是酸性氧化物且组成元素相同,B是形成酸雨的主要原因,B在一定条件下可以转化为D,则该方程式为 。已知煤燃烧所产生的烟气中含有B,若在煤中掺入适量生石灰,可减少B的排放,请写出其反应的化学方程式: 。
(3)E能使湿润的红色石蕊试纸变蓝,工业上常用E为原料制取硝酸,写出E催化氧化的化学方程式 ; E和氯气接触会产生白烟,该反应的化学方程式为 。
(4)由各分解产物的物质的量之比推测X的组成类似于明矾,则其化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用密度为1.25 g mL-1、质量分数为36.5%的浓盐酸配制240 mL 0.1 mol L-1的盐酸,请回答下列问题:
(1)浓盐酸的物质的量浓度为 。
(2)配制 240 mL 0.1 mol L-1的盐酸
应量取浓盐酸体积/mL | 应选用容量瓶的规格/mL |
(1)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) 。
A.用30 mL水洗涤烧杯内壁和玻璃棒23次,洗涤液均注入容量瓶,振荡
B.用量筒淮确量取所需的浓盐酸的体积,倒入烧杯中,再加入少量水(约30 mL), 用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线12 cm处
(4)若实验中遇到下列情况,对盐酸溶液的物质的量浓度有何影响(填“偏高”、“偏低”或“不变”)?
①用于稀释盐酸的烧杯未洗涤, 。
②容量瓶中原有少量蒸馏水, 。
③定容时观察液面俯视, 。
(5)若实验过程中出现如下情况如何处理?
①定容时加蒸馏水时超过了刻度 。
②向容量瓶中转移溶液时有滚液不慎有溶液溅出 。
③定容摇勻后发现液面下降 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值,下列说法正确的是
A.常温常压下,32gO2 、O3的混合物含有2Na个氧原子
B.6.8g熔融的KHSO4中含有0.1NA个阳离子
C.1L1mol/L的盐酸溶液中含HCl分子数为1NA
D.标准状况下,22.4 L氦气与22.4 L氟气所含原子数均为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列反应中,水既不是氧化剂,也不是还原剂的是
A.2Na+2H20=2Na0H+H2↑ B.C12+H20=HC1+HC10
C.2F2+2H20=4HF+02 D.2H20![]() 2H2↑+02↑
2H2↑+02↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1 g H2完全燃烧生成水蒸气放出热量121 kJ,且O2中1 mol O===O键完全断裂时吸收热量496 kJ,水蒸气中形成1 mol H—O键时放出热量463 kJ,则H2中1 mol H—H键断裂时吸收的热量为( )
A. 920 kJ B. 557 kJ C. 436 kJ D. 188 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,乙图是甲图的电解池进行电解时某个量(纵坐标x)随时间变化的函数图象(各电解池都用石墨作电极,不考虑电解过程中溶液浓度变化对电极反应的影响),这个量x是表示
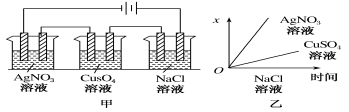
A.各电解池析出气体的体积
B.各电解池阴极质量的增加量
C.各电解池阳极质量的增加量
D.各电极上放电的离子总数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com