
【题目】在硝酸铝和硝酸镁的混合溶液中,逐滴加入稀氢氧化钠溶液,直至过量.下列表示氢氧化钠加入量(x)与溶液中沉淀的量(y)的关系示意图中正确的是( )
A. B.
B. C.
C. D.
D.
【答案】C
【解析】
试题分析:在硝酸铝和硝酸镁的混合溶液中,逐滴加入稀氢氧化钠溶液,首先发生反应:Al3++3OH﹣=Al(OH)3↓,Mg2++2OH﹣=Mg(OH)2↓,产生沉淀,随氢氧化钠溶液加入沉淀增大,当Al3+、Mg2+沉淀完全,沉淀最大,再加入氢氧化钠溶液,发生反应:Al(OH)3+OH﹣=AlO2﹣+2H2O,沉淀质量减小,最终沉淀为Mg(OH)2,再加入氢氧化钠溶液,沉淀质量不变,据此结合选项图象分析.
当Al3+沉淀完全时需加入6molOH﹣,即加入6molNaOH,生成Al(OH)32mol.
然后发生反应NH4++OH﹣=NH3H2O;NH4+完全反应时需加入2molOH﹣,即加入2molNaOH,沉淀氢氧化铝的量不变.
最后继续滴加NaOH,2molAl(OH)3溶解,发生反应Al(OH)3+OH﹣=AlO2﹣+2H2O,
当Al3+沉淀完全时需加入6molOH﹣,即加入6molNaOH,生成Al(OH)32mol.
然后发生反应NH4++OH﹣=NH3H2O;NH4+完全反应时需加入2molOH﹣,即加入2molNaOH,沉淀氢氧化铝的量不变.
最后继续滴加NaOH,2molAl(OH)3溶解,发生反应Al(OH)3+OH﹣=AlO2﹣+2H2O,直至过量.
解:在硝酸铝和硝酸镁的混合溶液中,逐滴加入稀氢氧化钠溶液,首先发生反应:Al3++3OH﹣=Al(OH)3↓,Mg2++2OH﹣=Mg(OH)2↓,产生沉淀,随氢氧化钠溶液加入沉淀增大,当Al3+、Mg2+沉淀完全,沉淀最大,再加入氢氧化钠溶液,发生反应:Al(OH)3+OH﹣=AlO2﹣+2H2O,沉淀质量减小,最终沉淀为Mg(OH)2,再加入氢氧化钠溶液,沉淀质量不变.
A、沉淀不能完全溶解,最终沉淀为Mg(OH)2,图象与实际不相符合,故A错误;
B、沉淀达最大量时,再加氢氧化钠溶液,氢氧化铝溶解,沉淀量减小,最后为定值,图象与实际不相符合,故B错误;
C、随氢氧化钠溶液加入沉淀增大,当Al3+、Mg2+沉淀完全,沉淀最大,再加入氢氧化钠溶液,发生反应:Al(OH)3+OH﹣=AlO2﹣+2H2O,沉淀质量减小,最后为定值,图象与实际相符合,故C正确;
D、当Al3+、Mg2+沉淀完全,沉淀最大,再加入氢氧化钠溶液,发生反应:Al(OH)3+OH﹣=AlO2﹣+2H2O,沉淀质量减小,最后为定值,图象与实际不相符合,故D错误.
故选:C.


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源: 题型:
【题目】化学与生产、生活、社会密切相关.下列说法中正确的是( )
A.合金材料中可能含有非金属元素
B.钢铁在潮湿的空气中放置,易发生化学腐蚀而生锈
C.二氧化硫和氯水均具有漂白性,可将两者混合使用增强漂白效果
D.氮化硅陶瓷、光导纤维、石英玻璃都属于新型无机非金属材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用锌与盐酸制取氢气,其他条件不变,下列能使该反应速率增大的是( )
A. 降低温度 B. 用铁代替锌
C. 增大盐酸浓度 D. 用锌粒代替锌粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E、F六种元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D、F为常见金属元素。A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759 g·L-1,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族。均含D元素的乙(金属阳离子)、丙、丁微粒间的转化全为非氧化还原反应,均含F元素的乙(单质)、丙、丁微粒间的转化全为氧化还原反应。请回答下列问题:
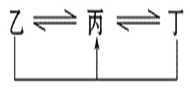
(1)单质B的结构式:_____ ____。
(2)A与C以1:1形成的化合物的电子式_ ____。
(3)F元素周期表中的位置:_____ _____。
(4)由A、C元素组成的氢化物庚和A、E元素组成的氢化物辛,热稳定性庚比辛_________(填“高”或“低”),理由是___ ____。
(5)B、C、E得电子后所形成的简单离子半径由小到大的顺序是____ _。(填具体离子符号)
(6)均含有F元素的乙与丁在溶液中发生反应的离子方程式____ _。均含有D元素的乙与丁在溶液中发生反应的离子方程式____ _
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分现有部分元素的性质与原子(或分子)结构如下表:
元素编号 | 元素性质与原子(或分子)结构 |
X | 地壳中含量最高的非金属元素 |
Y | M层比K层多1个电子 |
Z | 最外层电子数为内层电子数的0.6倍 |
W | 与氯形成的氯化物是生活中常用的调味品 |
(1)X形成的双原子分子的结构式为 ,X形成的氢化物的沸点在同族元素形成的氢化物中是 (填“最高”或“最低”),原因是 。
(2)金属冶炼Y单质的化学方程式为 。
(3)Y单质与W元素的最高价氧化物对应水化物恰好反应完全,向反应后的溶液中通入过量的CO2,发生反应的离子方程式为 。
(4)单质Cu在一定条件下与足量Z元素形成的强酸浓溶液反应生成的气体是 (填化学式),检验该气体的常用试剂 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、等杂质)中提取氧化铝的两种工艺流程如下:(提示:Na[Al(OH)4]+CO2(过量)═Al(OH)3↓+NaHCO3)

请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的离子方程式: ,固体A为(填名称) .
(2)验证滤液B含Fe3+,可取少量滤液并加入 .
(3)滤液B中加入过量烧碱发生的主要反应用离子方程式表示: .
(4)流程乙加入过量烧碱发生反应的化学方程式: .
(5)沉淀F的成分是(填化学式) .
(6)滤液E、K中溶质的主要成分是 (填化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组为了模拟工业流程从浓缩的海水中提取液溴,查阅资料知:Br2的沸点为59℃,微溶于水,有毒性。设计了如下操作步骤及主要实验装置(夹持装置略去):

①连接A与B,关闭活塞b、d,打开活塞a、c,向A中缓慢通入至反应结束;
②关闭a、c,打开b、d,向A中鼓入足量热空气;
③进行步骤②的同时,向B中通入足量SO2 ;
④关闭b,打开a,再通过A向B中缓慢通入足量Cl2 ;
⑤将B中所得液体进行蒸馏,收集液溴。
请回答:
(1)实验室中采用固液加热制备氯气的化学方程式为______________________;
(2)步骤②中鼓入热空气的作用为_________________________;
(3)步骤③B中发生的主要反应的离子方程式为_____________________。
(4)此实验中尾气可用______________(填选项字母)吸收处理。
a.水 b.浓硫酸 c.NaOH溶液 d.饱和NaCl溶液
(5)步骤⑤中,用下图所示装置进行蒸馏,收集液溴,将装置图中缺少的必要仪器补画出来。

(6)若直接连接A与C,进行步骤①和②,充分反应后,向锥形瓶中滴加稀硫酸,再经步骤⑤,也能制得液溴。滴加稀硫酸之前,C中反应生成了NaBrO3等,该反应的化学方程式为_________________。
(7)与B装置相比,采用C装置的优点为_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com