
| 序号 | 实验操作 | 实验目的 |
| A | Cl2、Br2分别与H2反应 | 比较氯、溴的非金属性强弱 |
| B | MgCl2、AlCl3溶液中分别通入NH3 | 比较镁、铝的金属性强弱 |
| C | 测定Na2CO3、Na2SO4两溶液的pH | 比较碳、硫的非金属性强弱 |
| D | 用同一电路测定等浓度的盐酸、醋酸两溶液的导电性 | 比较盐酸、醋酸的酸性强弱 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.非金属性越强,单质与氢气化合越容易;
B.MgCl2、AlCl3溶液与氨气反应的现象相同;
C.最高价含氧酸的酸性越强,对应非金属性越强;
D.盐酸和醋酸都是一元酸,浓度相同时,溶液导电能力越强,说明离子浓度越大,电离程度越大.
解答 解:A.非金属性越强,单质与氢气化合越容易,可根据Cl2、Br2分别与H2反应来判断Cl、Br的非金属性强弱,故A正确;
B.MgCl2、AlCl3溶液与氨气反应的现象相同,无法根据MgCl2、AlCl3溶液与氨气来比较Mg、Al的非金属性强弱,故B错误;
C.测定Na2CO3、Na2SO4两溶液的pH可判断碳酸和硫酸的酸性,碳酸和硫酸都是最高价含氧酸,酸性越强,对应非金属性越强,据此可比较碳、硫的非金属性强弱,故C正确;
D.盐酸和醋酸为一元酸,用同一电路测定等浓度的盐酸、醋酸两溶液的导电性,可判断溶液中离子浓度大小,从而可判断两溶液的酸性强弱,故D正确;
故选B.
点评 本题考查了化学实验方案的评价,题目难度不大,涉及盐的水解原理、氧化还原反应、元素周期律等知识,注意掌握判断金属性、非金属性及酸性强弱的方法,试题有利于提高学生的灵活应用能力.


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:解答题
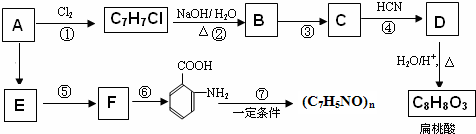
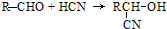
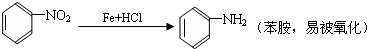
 ;扁桃酸
;扁桃酸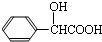 .
. .
. .
.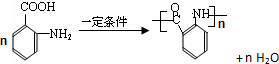 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
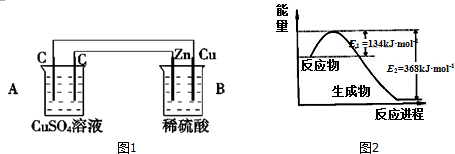
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| ① | ② | ③ | ④ | |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
| pH | 11 | 11 | 3 | 3 |
| A. | 分别加水稀释10倍,四种溶液的pH:①>②>④>③ | |
| B. | 将③、④分别稀释到pH=5,由水电离出氢离子的浓度均减小100倍 | |
| C. | 在①、②中分别加入适量的氯化铵晶体后,①的pH减小,②的pH不变 | |
| D. | 将①、④两种溶液等体积混合,所得溶液中:c(OH-):c(H+)>1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
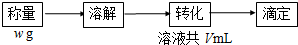
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 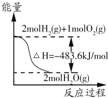 表示2 mol H2(g)所具有的能量一定比2 mol气态水所具有的能量多483.6 kJ | |
| B. | 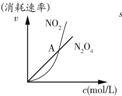 表示恒温恒容条件下发生的可逆反应2NO2(g)?N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 | |
| C. | 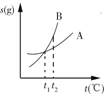 表示A、B两物质的溶解度随温度变化情况,将t1℃时的A、B饱和溶液分别升温至t2℃时,溶质的质量分数B>A | |
| D. | 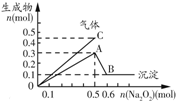 表示向一定量的Mg2+、NH4+、Al3+混合溶液中加入Na2O2的量与生成沉淀和气体的量的关系,则此溶液中n(Mg2+)、n(NH4+)、n(Al3+)的比为1:2:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.46 g | B. | 3.20 g | C. | 3.59 g | D. | 7.41 g |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 第16、17列都是非金属元素 | |
| B. | 第1列金属元素和第17列元素的单质熔、沸点变化趋势相反 | |
| C. | 只有第2列元素原子最外层有2个电子 | |
| D. | 在18列元素中,第3列元素种类最多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com