
【题目】我国某科研团队以N2为原料合成了超高含能材料聚合氮——以氮氮单键(N-N)结合的具有网状结构的聚合体。有关化学键的键能数据如下:
化学键 | N≡N | N=N | N-N |
键能/(kJ/mol) | 946 | 419 | 159 |
下列分析不正确的是
A. 氮原子的结构示意图:![]() B. 聚合氮转变为N2会释放能量
B. 聚合氮转变为N2会释放能量
C. 高温有利于聚合氮的合成 D. 低压有利于聚合氮的合成
科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,在一定温度下可发生以下反应:2N2O5(g) ![]() 4NO2(g)+O2(g)△H>0,T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:
4NO2(g)+O2(g)△H>0,T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:
时间/s | 0 | 500 | 1000 | 1500 |
c(N2O5)mol/L | 5.00 | 3.53 | 2.50 | 2.50 |
下列说法中不正确的是:
A. T1温度下,500s时O2的浓度为0.74mol/L
B. 平衡后其他件不变,将容器的体积压缩到原来的1/2,则再平衡时c(N2O5)>5.00 mol/L
C. T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2
D. T1温度下的平衡常数为K1=125,平衡时N2O5的转化率为0.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物W在工业上常用作溶剂和香料,其合成方法如下:

下列说法正确的是
A. M、N、W均能发生加成反应、取代反应
B. N、W组成上相差一个CH2原子团,所以互为同系物
C. W属于脂肪,能发生皂化反应
D. M的二氯代物有8种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把金属A放入盐B(NO3)2的溶液中,发生如下反应:A+B2+=A2++B,以下叙述正确的是( )
A.常温下金属A一定能与水反应,B一定不能与水反应
B.A与B用导线连接后放入酒精中,一定形成原电池
C.A、B用导线连接后放入B(NO3)2的溶液中,一定有电流产生
D.由A与B形成的原电池,A一定是正极,B一定是负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属是不可再生的资源,通过回收废旧的锂电池提取锂、铝、钴等重要的金属具有重大的意义。已知锂电池的正极材料为LiCoO2、炭黑、铝箔及有机粘合剂,下面是回收的工艺流程:

(1)滤液X中通入过量CO2时发生的主要反应的离子方程式为___________
(2)写出酸浸时加入H2SO4、H2O2反应的化学方程式______________________
(3)实验室中萃取分离CoSO4、Li2SO4溶液时需要加入有机物W,若实验过程中使用如图装置,则该装置中存在的主要错误有______________________
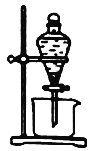
(4)已知部分物质的溶解度(g/100gH2O)情况如下表所示:
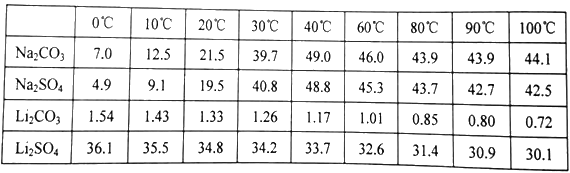
写出浓缩后的溶液中加入饱和碳酸钠溶液的离子反应方程式______________________;为提高Li2CO3的产率,最后过滤实验中需要注意的问题是______________________
(5)若废旧的锂电池拆解后先使用酸溶解,最终也可以得到Al(OH)3、CoSO4、Li2CO3。在酸浸中若Al3+浓度为0.1moL·L-1,则常温时pH>______________________才能够开始形成氢氧化铝沉淀(已知氢氧化铝Ksp=1.3×10-33、lg4.26=0.6、![]() =2.35)
=2.35)
(6)已知100g废旧的锂电池中钴酸锂(LiCoO2)的含量为9.8%,若按照上述生产流程,可以生成2.4gLi2CO3,则其产率为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证木炭可和浓硫酸反应生成的气体产物,选用下图中的仪器(含所盛物质)组装成套实验装置,回答下列问题。

(1)在实验进行中,按气流方向从左到右的顺序,导管口的三处连接应该是接___,__接__,__接__。
(2)D中右边试管的作用是_____________________。
(3)试管B、C中各有什么现象,才能表示已检验出二氧化碳?__________。
(4)试管D中能否用饱和NaHCO3溶液代替酸性KMnO4溶液?说明理由:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向20 mL 0.40 mol/L H2O2溶液中加入少量KI溶液:ⅰ.H2O2+I-=H2O+IO﹣;ⅱ.H2O2+IO﹣= H2O+O2↑+ I﹣。H2O2分解反应过程中能量变化和不同时刻测得生成O2的体积(已折算标准状况)如下。

t/min | 0 | 5 | 10 | 15 | 20 |
V(O2)/mL | 0.0 | 12.6 | 20.16 | 28.0 | 32.7 |
下列判断不正确的是
A. 从图中可以看出,KI能增大H2O2的分解速率
B. 反应ⅰ是放热反应,反应ⅱ是吸热反应
C. 0~10 min的平均反应速率:v(H2O2)≈9.0×10-3 mol/(L·min)
D. H2O2在反应过程中既体现了氧化性,又体现了还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子化合物G是一种重要的化工产品,可由烃A(C3H6)和苯合成。合成G的流程图如下:

已知:①B和C中核磁共振氢谱分别有4种和3种峰。
②CH3Cl+NaCN→CH3CN+NaCl
③CH3CN![]() CH3COOH
CH3COOH
④![]()
请回答下列问题:
(1)A的名称是___________。
(2)①的反应类型是___________,⑥的反应类型是___________。
(3)D的结构简式是______________________。
(4)E中官能团的名称是___________。
(5)⑦的反应方程式是_________________________________。
(6)F的同分异构体有多种,符合下列条件的有___________种。
①苯环对位上有两个取代基,其中一个是NH2 ②能水解 ③核磁振谱有5个峰
写出符合上述条件的一种同分异构体的结构简式______________________。
(7)参照上述流程图,写出用乙烯、NaCN为原料制备聚酯 的合成路线___________(其它无机物任选)
的合成路线___________(其它无机物任选)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com