
| A. | H2SO4 Na2CO3 Ca(OH)2 | B. | HCl NaOH K2CO3 | ||
| C. | H2CO3 C2H5OH Na2SO4 | D. | Ba(OH)2 H3PO4 KOH |
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
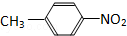 和
和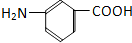
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 棕红色NO2加压后颜色先变深后变浅 | |
| B. | Fe(SCN)3溶液中加入固体KSCN后颜色变深 | |
| C. | 氯水宜保存在低温、避光条件下 | |
| D. | SO2催化氧化成SO3的反应,往往加入过量的空气 | |
| E. | 打开易拉罐有大量气泡冒出 | |
| F. | 加催化剂,使氮气和氢气在一定条件下转化为氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 醇与氢卤酸反应是制备卤代烃的重要方法.实验室制备溴乙烷的装置如图所示,试管d中装有少量蒸馏水.已知溴乙烷的沸点为38.4℃,密度为1.43g/mL;可能存在的副反应有:加热反应过程中反应混合物会呈现黄色甚至红棕色;醇在浓硫酸的存在下脱水生成烯和醚等.实验步骤中:在圆底烧瓶中加入10g乙醇、足量浓硫酸,然后加入研细的20.6g溴化钠和几粒碎瓷片.
醇与氢卤酸反应是制备卤代烃的重要方法.实验室制备溴乙烷的装置如图所示,试管d中装有少量蒸馏水.已知溴乙烷的沸点为38.4℃,密度为1.43g/mL;可能存在的副反应有:加热反应过程中反应混合物会呈现黄色甚至红棕色;醇在浓硫酸的存在下脱水生成烯和醚等.实验步骤中:在圆底烧瓶中加入10g乙醇、足量浓硫酸,然后加入研细的20.6g溴化钠和几粒碎瓷片.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com