
【题目】在Na与H2O的反应中( )
A. Na是氧化剂
B. H2是氧化产物
C. 反应的实质是钠置换水电离出的少量的H+
D. 反应的实质是钠置换水中的氢气
科目:高中化学 来源: 题型:
【题目】直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2 .
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:;
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是;
(3)吸收液吸收SO2的过程中,pH随n(SO32﹣):n(HSO3﹣)变化关系如表:
n(SO32﹣):n(HSO3﹣) | 91:9 | 1:1 | 9:91 |
pH | 8.2 | 7.2 | 6.2 |
①上表判断NaHSO3溶液显性,用化学平衡原理解释;
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):;
a.c(Na+)=2c(SO32﹣)+c(HSO3﹣)
b.c(Na+)>c(HSO3﹣)>c(SO32﹣)>c(H+)=c(OH﹣)
c.c(Na+)+c(H+)=c(SO32﹣)+c(HSO3﹣)+c(OH﹣)
(4)当吸收液的pH降至约为6时,需送至电解槽再生.再生示意图如下: 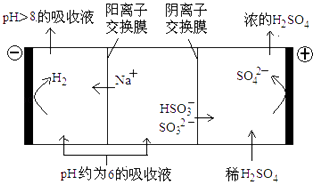
①HSO3﹣在阳极放电的电极反应式是;
②当阴极室中溶液PH升至8以上时,吸收液再生并循环利用.简述再生原理 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于钠的化合物的说法正确的组合是
①NaCl可作厨房调味品,也可用于氯碱工业
②Na2O2可用于呼吸面具或潜水艇中的供氧剂
③Na2CO3水溶液显碱性,可用于去除油污
④NaHCO3受热易分解放出CO2 , 可用来制作糕点( )
A.只有①②③
B.只有①③④
C.只有②③④
D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于分子组成为CxHy的烷烃、烯烃、炔烃的说法中不正确的是( )
A.当x≤4时,常温常压下均为气体
B.y一定为偶数
C.燃烧1molCxHy时,消耗氧气(x+ ![]() )mol
)mol
D.在密闭容器中完全燃烧,150℃时测得的压强一定比燃烧前增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A.NH4HSO3与足量的2 mol/L硫酸溶液混合微热,产生的刺激性气味的气体是NH3
B.
用如图所示装置探究铜丝与过量浓硫酸的反应,为确认CuSO4生成,向①中加水,观察颜色
C.取适量铁粉与一定量的稀硝酸恰好完全反应,体现酸性的硝酸与体现氧化性的硝酸的物质的量之比为3:1
D.电解熔融氯化铝制备金属铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.离子反应的活化能几乎为零
B.发生有效碰撞的分子一定是活化分子
C.活化能对化学反应的反应热会产生影响
D.活化能指活化分子多出其它反应物分子的那部分能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数,下列叙述中正确的是( )
A.标准状况下,22.4L H2中所含质子数、中子数均为2NA
B.32g O2气体和32g O3气体的分子数之比为3:2
C.1L 1molL﹣1的盐酸中所含粒子总数为2NA
D.71g氯气与足量铁粉充分反应,转移的电子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙为常见单质,丁为两种元素组成的化合物,A~H均为常见的化合物,其中B的焰色反应为黄色,C能使品红溶液褪色,在一定条件下,各物质相互转化关系如图所示. 
(1)用化学式表示:丙为 , E为 .
(2)A的电子式为 .
(3)写出B→G的化学方程式: . 写出C+丁→H的离子方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组根据老师的学案设计实验对碳酸钠和碳酸氢钠的性质进行研究.
(1)甲同学设计除去碳酸氢钠溶液中碳酸钠杂质的方法:向溶液中通入足量的二氧化碳.请写出相关反应的离子方程式 .
(2)乙同学设计如图实验装置,比较碳酸氢钠和碳酸钠的热稳定性,并检验分解产物.最好应在a试管底部加入(填化学式). 
(3)小苏打长期放置在空气中会变质(部分转变为碳酸钠),丙同学称取27.4g变质小苏打样品,经过充分加热、冷却、称量,所得固体的质量为21.2g,则原混合物中碳酸钠的质量为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com