
【题目】下列有关溶液组成的描述合理的是( )
A. 弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3-
B. 酸性溶液中可能大量存在Na+、ClO-、SO42-、I-
C. 中性溶液中可能大量存在Fe3+、K+、Cl-、SO42-
D. 无色溶液中可能大量存在Al3+、NH4+、Cl-、HS-
科目:高中化学 来源: 题型:
【题目】N、P同属于元素周期表的第VA族元素。
(1)基态磷原子的价电子排布图是____________
(2)NCl3的VSEPR模型名称是,中心原子杂化轨道类型是__________________。
(3)“笑气”(N2O)是人类最早应用于医疗的麻醉剂之一。有关理论认为原子总数相同、价电子总数相同的粒子即等电子体具有相似的化学键特征,它们的许多性质是接近的。写出N2O的一种有第二周期非金属元素组成的等电子体分子。
(4)沸点比较:PH3NH3(填“>”、“=”、“<”),理由是____________。
(5)已知键能:H-H键能为436KJ·mol-1,N-H键能为391KJ·mol-1,N≡N键能为945.6kJmol-1.。则N2+3H2![]() 2NH3,生成2molNH3时,共放热_________KJ
2NH3,生成2molNH3时,共放热_________KJ
(6)NH3极易溶于水,原因是_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在溶液中能大量共存,加入OH-有沉淀产生,加入H+有气体放出的是
A.Na+、Cu2+、Cl-、SO![]() B.Fe3+、K+、SO
B.Fe3+、K+、SO![]() 、NO
、NO![]()
C.Na+、CO![]() 、OH-、NO
、OH-、NO![]() D.Na+、Ca2+、Cl-、HCO
D.Na+、Ca2+、Cl-、HCO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—定温度下,水溶液中H+和OH-的浓度变化曲线如图,下列说法正确的是( )

A. 升高温度,可能引起由c向b的变化
B. 该温度下,水的离子积常数为l.0×10-13
C. 该温度下,加入FeCl3可能引起由b向a的变化
D. 该温度下,稀释溶液可能引起由c向d的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硅(Si3N4)是一种优良的高温结构陶瓷,在工业生产和科技领域中有重要用途。
Ⅰ.工业上有多种方法来制备氮化硅,下面是几种常见的方法:
(1)方法一 直接氮化法:在1300~1400 ℃时,高纯粉状硅与纯氮气化合,其反应方程式为3Si+2N2![]() Si3N4
Si3N4
(2)方法二 可以用NH3和SiH4(硅烷)在一定条件下反应,并在600 T的加热基板上生成氮化硅膜,其反应方程式为___________________。
(3)方法三 化学气相沉积法:在高温条件下利用四氯化硅气体、纯氮气、氢气反应生成氮化硅和HCl,与方法一相比,用此法制得的氮化硅纯度较高,其原因是___________________。
(4)方法四 Si(NH2)4热分解法:先用四氯化硅与氨气反应生成Si(NH2)4和一种气体__________________(填分子式);然后使Si(NH2)4受热分解,分解后的另一种产物的分子式为_________________。
Ⅱ.工业上制取高纯硅和四氯化硅的生产流程如下:
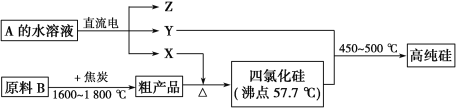
已知:X、高纯硅、原料B的主要成分都可与Z反应,Y与X在光照或点燃条件下可反应,Z的焰色呈黄色。
(1)写出焦炭与原料B中的主要成分反应的化学方程式:__________________
(2)上述生产流程中电解A的水溶液时,以Cu为阳极电解A的水溶液电解反应方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:4NH3(g)+5O2(g) ![]() 4NO(g)+6H20(g) ΔH=-1025 kJ·mol-1。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是
4NO(g)+6H20(g) ΔH=-1025 kJ·mol-1。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某高校老师要求学生配制0.1 mol/L的KMnO4溶液100mL。完成下列实验。
【实验一】研究温度对反应速率的影响,学生取两只试管,均加入4mL 0.1 mol/L的KMnO4酸性溶液和10mL 0.1mol/L H2C2O4(乙二酸)溶液,振荡,A试管置于热水中,B试管置于凉水中,记录溶液褪色所需的时间。要用 来酸化KMnO4溶液,褪色所需时间tA tB(填“>”、“=”或“<”)。写出此反应的离子方程式: 。
【实验二】测定某乙二酸溶液的浓度,具体操作为:
(1)滴定:准确量取25.00 mL乙二酸溶液于锥形瓶中,加少量酸酸化,将KMnO4溶液装入________(填“酸式”或“碱式”)滴定管,进行滴定操作。在实验中发现,刚滴下少量KMnO4溶液时,溶液迅速变成紫红色。将锥形瓶摇动一段时间后,紫红色慢慢消失;再继续滴加时,紫红色就很快褪色了。
请解释原因: 。待到 ,证明达到滴定终点。
(2)计算:再重复上述操作2次,记录实验数据如下。
序号 | 滴定前读数(mL) | 滴定后读数(mL) |
1 | 0.00 | 20.10 |
2 | 1.00 | 20.90 |
3 | 0.00 | 22.10 |
则此乙二酸溶液的浓度为 。
(3) 误差分析:下列操作会导致乙二酸溶液浓度偏高的是 。
A. 配制KMnO4溶液定容时,仰视观察刻度线
B.未用待测液乙二酸润洗滴定管
C.滴定前锥形瓶有少量水
D.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
E.滴定时振荡锥形瓶有溶液飞溅出去
F.观察读数时,滴定前仰视,滴定后俯视
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】构成DNA、唾液淀粉酶、固醇、纤维素的化学成分中,共有的化学元素是
A. C、H、0、N、P B. C、H、0、N、S
C. C、H、0 D. C、H、0、N
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com