
分析 将方程式相加后使次氯酸钙和硫代硫酸钠在同一方程式中,根据次氯酸钙和硫代硫酸钠之间的关系式计算次氯酸钙的质量,然后根据质量分数公式计算即可.
解答 将2.0g漂白粉配制成250mL溶液,取出25mL溶液,所以25mL溶液中漂白粉的质量为:2.0g×$\frac{1}{10}$=0.2g,
Ca(ClO)2+4KI+2H2SO4=CaCl2+2K2SO4+2H2O+2I2 ①
2Na2S2O3+I2=Na2S4O6+2NaI②
设次氯酸钠的质量为x,根据反应①②可得关系式:
Ca(ClO)2~4Na2S2O3
143g 4mol
x 0.1mol•L-1×0.02L
则:x=$\frac{143g×0.1mol/L×0.02L}{4mol}$=0.0715g,
所以漂白粉中Ca(ClO)2的质量分数为:$\frac{0.0715g}{0.2g}$×100%=35.75%,
答:漂白粉中Ca(ClO)2的质量分数是35.75%.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应原理为解答关键,注意配制的溶液体积与滴定时溶液的体积关系,掌握关系式法在化学计算中的应用,试题充分考查学生的分析、理解能力及化学计算能力,


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
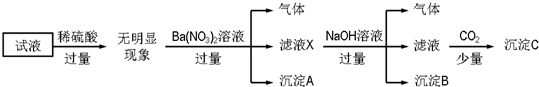
| A. | 沉淀A是BaSO4,说明原试液中一定含有SO42- | |
| B. | 滤液X中大量存在的阳离子有NH4+、Fe3+和Ba2+ | |
| C. | 沉淀C只有一种成分 | |
| D. | 原溶液中一定大量存在的离子只有:NH4+、Fe2+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
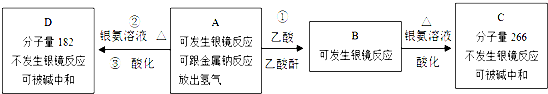
 、C
、C
 +2[Ag(NH3)2]OH$\stackrel{△}{→}$
+2[Ag(NH3)2]OH$\stackrel{△}{→}$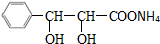 +3NH3+2Ag↓+H2O
+3NH3+2Ag↓+H2O (或
(或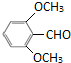 )
)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu(OH)2 | B. | CuCO3 | C. | CuCO3•CuO | D. | Cu2(OH)2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属性:S>Cl>F | B. | 碱性:NaOH>Mg( 0H)2>Al( 0H)3 | ||
| C. | 稳定性:PH3<H2S<HF | D. | 离子半径:02->Na+>Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a>b | B. | b>a | C. | a=b | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
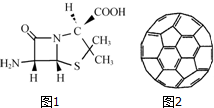 在人类文明的历程中,许多物质发挥过重要作用,如铁、硝酸钾、青霉素、聚乙烯、二氧化硅、富勒烯、含铬物质等.
在人类文明的历程中,许多物质发挥过重要作用,如铁、硝酸钾、青霉素、聚乙烯、二氧化硅、富勒烯、含铬物质等.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com