
| A. | 两个反应中都只有一种元素化合价发生改变 | |
| B. | 两个过程生成KCl的物质的量相同 | |
| C. | 发生氧化反应的元素相同 | |
| D. | 发生还原反应的元素相同 |
分析 ①发生2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,Cl元素的化合价降低,O元素的化合价升高;②发生4KClO3$\frac{\underline{\;470℃\;}}{\;}$3KClO4+KCl,Cl元素的化合价既升高又降低,以此来解答
解答 解:①发生2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,Cl元素的化合价降低,O元素的化合价升高;②发生4KClO3$\frac{\underline{\;470℃\;}}{\;}$3KClO4+KCl,Cl元素的化合价既升高又降低,
A.①中Cl、O元素发生化合价发生改变,②中Cl元素发生化合价发生改变,故A错误;
B.①中1molKClO3分解生成1molKCl,②中1molKClO3分解生成0.25molmolKCl,故B错误;
C.①中O元素发生氧化反应,②中Cl元素发生氧化反应,故C错误;
D.①中Cl元素的化合价降低发生氧化反应,②中Cl元素的化合价降低发生氧化反应,故D正确.
故选D.
点评 本题考查氧化还原反应,侧重基本概念的考查,注意把握元素的化合价变化即可解答,题目难度不大,侧重于考查学生的分析能力.


科目:高中化学 来源: 题型:选择题
| A. | 硫(俗称硫磺)是一种黄色晶体,质脆.不溶于水,易溶于酒精 | |
| B. | 硅酸钠的水溶液俗称水玻璃,是制备硅胶和木材防火剂的重要原料 | |
| C. | 氧化铝是冶炼金属铝的原料,也是比较好的耐火材料,可用来制造耐火坩埚、耐火管 | |
| D. | FeO是一种黑色粉末,不稳定,在空气中受热,迅速被氧化成Fe3O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,1.5 mol N2的体积约为33.6 L | |
| B. | NaOH的摩尔质量是40 g | |
| C. | 150mL 1 mol/LNaCl溶液与100mL 1 mol/LAlCl3溶液中的n(Cl-)相等 | |
| D. | 同温同压下,相同体积的C12和SO2气体所含的分子数一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
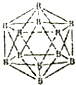 晶体硼的结构单元是正二十面体,每个单元中有12个硼原子(如图).若其中有两个原子为10B,其余为11B,则该结构单元结构类型有( )
晶体硼的结构单元是正二十面体,每个单元中有12个硼原子(如图).若其中有两个原子为10B,其余为11B,则该结构单元结构类型有( )| A. | 1种 | B. | 3种 | C. | 5种 | D. | 4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
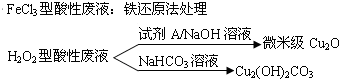
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
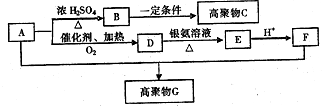 有机物A常用作有机合成的中间体.15.2g该有机物燃烧生成26.4gCO2和14.4gH2O;质谱图表明其相对分子质量为76,红外光谱分析表明A分子中含有O-H键和C-O键.核磁共振氢谱上有三个峰,峰面积之比为2:1:1.A能发生如图转化:
有机物A常用作有机合成的中间体.15.2g该有机物燃烧生成26.4gCO2和14.4gH2O;质谱图表明其相对分子质量为76,红外光谱分析表明A分子中含有O-H键和C-O键.核磁共振氢谱上有三个峰,峰面积之比为2:1:1.A能发生如图转化: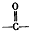 ,则H的结构简式可能为CH3CH2CHO、
,则H的结构简式可能为CH3CH2CHO、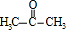 .
.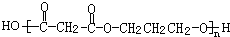 +(2n-1)H2O.
+(2n-1)H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
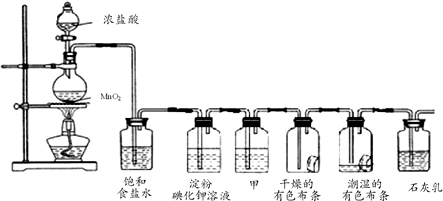
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com