
科目:高中化学 来源: 题型:
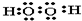
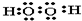


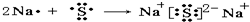
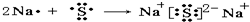
查看答案和解析>>
科目:高中化学 来源: 题型:
 位于元素周期表前四周期的五种元素A、B、C、D、E,原子序数依次增大.A元素原子的最外层电子排布可表示为:asaap2a,B元素在地壳中含量居第二位,C与B位于同一周期,且是该周期元素中电负性最大的元素,D元素的+3价离子的3d亚层为半充满,E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子.
位于元素周期表前四周期的五种元素A、B、C、D、E,原子序数依次增大.A元素原子的最外层电子排布可表示为:asaap2a,B元素在地壳中含量居第二位,C与B位于同一周期,且是该周期元素中电负性最大的元素,D元素的+3价离子的3d亚层为半充满,E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子.查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)写出下列元素的元素符号:B________,D________;写出E的两种常见同素异形体的名称________;C、E的氢化物的沸点高低关系是________(用分子式和“>”表示)。
(2)X是C的最高价氧化物的水化物,它是重要的化学试剂,其浓溶液需避光保存,这是因为(用化学方程式表示)____________________________________。
(3)Y是C的最高价氧化物的水化物和其氢化物反应生成的化合物,常温时,pH=a的X、Y两种溶液中由水电离出来的H+浓度之比为__________________。
(4)X与A、B组成的某化合物在一定条件下反应制得一种常见的烈性炸药,其反应的化学方程式为____________________________________。
(5)由上述元素组成的某化合物其化学式为B
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com