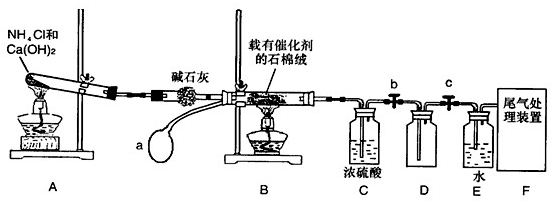
解:(1)装置为实验室制氨气的实验装置,目的是制取氨气,所以化学方程式为:2NH
4Cl+Ca(OH)
2
2NH
3↑+CaCl
2+2H
2O;故答案为:2NH
4Cl+Ca(OH)
2
2NH
3↑+CaCl
2+2H
2O;
(2)气密性检查是:将A中导管下端浸入水中,用双手紧握大试管底部,导管口有气泡产生,双手离开,导管产生一段水拄,说明装置A不漏气;
故答案为:用双手紧握大试管底部,导管口有气泡产生,双手离开,导管产生一段水拄,说明装置A不漏气;
(3)1molNO
2与液态水反应生成HNO
3溶液和NO气体放出热量45.5kJ,热化学方程式为3NO
2(g)+H
2O(l)=2HNO
3(aq)+NO(g)△H=-136.5kJ?mol
-1,两种反应物,需加入一种物质的量来提高另一种物质的转化率,改变温度会改变平衡,对有气体参加的反应,改变压器平衡移动; 采取的措施:因反应是放热反应,所以降低温度平衡右移,二氧化氮转化率提高;反应前后气体体积减少,所以增大压强平衡右移,二氧化氮转化率提高;所以选BC;
故答案为:3NO
2(g)+H
2O(l)=2HNO
3(aq)+NO(g)△H=-136.5kJ?mol
-1;BC;
(4)制得的二氧化氮气体会转化为四氧化二氮,形成化学平衡 2NO
2?N
2O
4,正向是放热反应,二氧化氮气体是红棕色,四氧化二氮是无色气体,所以放入冰中温度降低,平衡右移,混合气体颜色变浅;故答案为:颜色变浅;
(5)浓硫酸具有吸水性,可以干燥与之不反应的气体,同时吸收过量的氨气;故答案为:干燥气体,吸收多余的NH
3;
(6)利用浓氨水分解制取氨气,或把浓氨水滴入固体氢氧化钠,发生反应为NH
3?H
2O

NH
3↑+H
2O;
故答案为:NH
3?H
2O

NH
3↑+H
2O;
分析:(1)根据实验装置图,结合反应过程可知,A装置是实验室制取氨气的装置,反应化学方程式为2NH
4Cl+Ca(OH)
2
2NH
3↑+CaCl
2+2H
2O;
(2)检查装置A的气密性,设法使装置内外形成气压差是气密性检查的常用手段,简述出检查装置气密性的这个操作过程即可解答本题.
(3)1molNO
2与液态水反应生成HNO
3溶液和NO气体放出热量45.5kJ,书写热化学方程式注意标注物质聚集状态、配平化学方程式、给定条件下反应的焓变;欲提高NO
2的转化率,使平衡向右移动即可.
(4)实验结束后,关闭止水夹b、c,将装置D浸入冰水中,根据实验装置可知D装置中收集的是干燥的二氧化氮气体,存在平衡 2NO
2?N
2O
4,正向是放热反应,二氧化氮气体是红棕色,四氧化二氮是无色气体,所以放入冰中温度降低,平衡右移,混合气体颜色变浅;
(5)浓硫酸具有吸水性,可以干燥与之不反应的气体,同时吸收过量的氨气;
(6)可以利用浓氨水分解制取氨气;
点评:本题考查了实验室制氨气的原理和装置,装置气密性检查,催化氧化反应的条件,影响化学平衡的因素,同时考查了浓硫酸、氨气、二氧化氮、四氧化二氮等物质的性质应用.

 2NH3↑+CaCl2+2H2O;故答案为:2NH4Cl+Ca(OH)2
2NH3↑+CaCl2+2H2O;故答案为:2NH4Cl+Ca(OH)2 2NH3↑+CaCl2+2H2O;
2NH3↑+CaCl2+2H2O; NH3↑+H2O;
NH3↑+H2O; NH3↑+H2O;
NH3↑+H2O; 2NH3↑+CaCl2+2H2O;
2NH3↑+CaCl2+2H2O;

 名校课堂系列答案
名校课堂系列答案
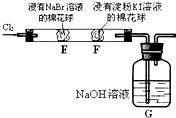 某化学小组用如图所示装置验证卤素单质氧化性的相对强弱.下列说法不正确的是
某化学小组用如图所示装置验证卤素单质氧化性的相对强弱.下列说法不正确的是