
【题目】已知![]() 、
、![]() 、
、![]() 是三种原子序数依次增大的短周期元素。甲、乙、丙分别是三种元素形成的单质,
是三种原子序数依次增大的短周期元素。甲、乙、丙分别是三种元素形成的单质,![]() 、
、![]() 、
、![]() 、
、![]() 分别是由
分别是由![]() 、
、![]() 、
、![]() 形成的二元化合物,且
形成的二元化合物,且![]() 与
与![]() 分子中均含有10个电子。它们之间转化关系如图所示。下列说法正确的是( )。
分子中均含有10个电子。它们之间转化关系如图所示。下列说法正确的是( )。
A.原子半径:![]()
B.![]() 与
与![]() 形成的化合物只含极性键
形成的化合物只含极性键
C.![]() 有多种同素异形体,且均具有高熔点、高沸点、硬度大的性质
有多种同素异形体,且均具有高熔点、高沸点、硬度大的性质
D.稳定性:![]()
【答案】D
【解析】
A与C中均含有10个电子,A燃烧可生成C,由转化关系可知A应为CH4,丙为O2,B为CO2,C为H2O; B、C都可与物质乙在高温下反应,物质乙应为碳单质,则D为CO,甲为H2;故X为H元素,Y为C元素, Z为O元素;
A.由分析可得X、Y、Z分别为氢元素、碳元素、氧元素,原子半径C>O>H,A错误;
B.H和C形成的化合物包括各种烃,肯定有极性键(C-H键),可能有非极性键(C-C键、C=C键、![]() 键等),B错误;
键等),B错误;
C.碳的同素异形体中C60属分子晶体,熔沸点并不是很高,而石墨的硬度也较小,C错误;
D.由于非金属性C<O,所以简单氢化物稳定性CH4<H2O,D正确。
故选D。


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】把0.4molX气体和0.6molY气体混合于2L密闭容器中,使它们发生如下反应:4X(g)+5Y(g) ![]() nZ(g)+6W(g)。2min末已生成0.3molW,若测知以Z的浓度变化表示的反应速率为0.05mol/(L·min),试计算
nZ(g)+6W(g)。2min末已生成0.3molW,若测知以Z的浓度变化表示的反应速率为0.05mol/(L·min),试计算
(1)前2min内用W的浓度变化表示的平均反应速率为_______________。
(2)2min末时Y的浓度为_____________________________。
(3)化学反应方程式中n=_____________________________。
(4)2min末,恢复到反应前温度,体系内压强是反应前压强的__________倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容密闭容器中,下列情况表明反应A(s)+2B(g)![]() C(g)+D(g) 已达到反应限度的是
C(g)+D(g) 已达到反应限度的是
A. 混合气体的密度保持不变B. 有1mol C生成的同时有1mol D生成
C. 混合气体的总物质的量保持不变D. 有1 mol A生成的同时有1mol C消耗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将充满NO2和O2的试管倒立于水槽中,充分反应后,剩余气体的体积为原混合气体体积的![]() ,则原混合气体中NO2和O2的体积之比是
,则原混合气体中NO2和O2的体积之比是
A.8:1B.7:3C.1:7D.4:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题组用废旧铁壳无汞碱性锌锰电池为原料,制备一种新型材料![]() ,其工艺流程如图所示:
,其工艺流程如图所示:
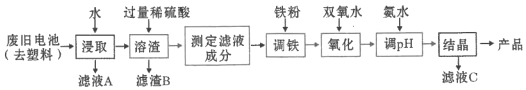
(1)碱性锌锰电池的工作原理:________![]() ________
________![]() ________
________![]() ________
________![]() ________(配平方程式),其中的电解质溶液是
________(配平方程式),其中的电解质溶液是![]() 溶液。滤液
溶液。滤液![]() 中主要溶质的电子式为______。
中主要溶质的电子式为______。
(2)已知![]() 中锰元素的化合价与实验室用二氧化锰制取氯气时还原产物中锰元素的化合价相同,则铁元素的化合价为________。
中锰元素的化合价与实验室用二氧化锰制取氯气时还原产物中锰元素的化合价相同,则铁元素的化合价为________。
(3)“溶渣”工序中稀硫酸与铁反应生成的硫酸亚铁可将![]() 价锰的化合物全部还原成
价锰的化合物全部还原成![]() ,写出该反应的离子方程式________。
,写出该反应的离子方程式________。
(4)“调铁”工序的目的是调整滤液中铁离子的总浓度,使其中金属元素的物质的量之比与产品的化学式![]() 相符合。
相符合。
①写出“调铁”工序中可能发生反应的离子方程式________,________。
②若“测定滤液成分”结果为![]() ,
,![]() ,滤液体积为
,滤液体积为![]() ,“调铁”工序中,需加入的铁粉质量为________
,“调铁”工序中,需加入的铁粉质量为________![]() (忽略溶液体积变化,用含
(忽略溶液体积变化,用含![]() 、
、![]() 的代数式表示)。
的代数式表示)。
(5)在“氧化”工序中,加入双氧水的目的是把![]() 氧化为
氧化为![]() ;生产过程中发现实际消耗双氧水的量大于理论值,其可能原因除温度外,主要是________。
;生产过程中发现实际消耗双氧水的量大于理论值,其可能原因除温度外,主要是________。
(6)从滤液![]() 中还可分离出一种氮肥,该氮肥的溶液中的离子浓度由小到大的顺序为________。
中还可分离出一种氮肥,该氮肥的溶液中的离子浓度由小到大的顺序为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题:
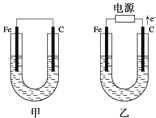
(1)若两池中电解质溶液均为CuSO4溶液,则反应一段时间后:
①有红色物质析出的是甲池中的___棒,乙池中的___棒。
②乙池中阳极的电极反应式是___。
(2)若两池中电解质溶液均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式___。
②甲池中碳极上电极反应式是___,乙池碳极上电极反应属于___(填“氧化反应”或“还原反应”)。
③将湿润的KI淀粉试纸放在乙池碳极附近,发现试纸变蓝,反应的化学方程式为___。
④若乙池转移0.02mole﹣后停止实验,池中电解质溶液体积是200mL,则溶液混合均匀后的pH=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
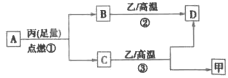
【题目】某工厂废液中含有氯化钠、氯化铜和氯化亚铁。某课外小组要从废液中回收铜并得到铁红(主要成分Fe2O3),要求全过程不引入其他金属元素。设计实验方案如图所示,回答下列问题。

(1)加入过量A溶解后,在进行操作a时玻璃棒的作用是______________________。
(2)工厂废液中加入过量A的目的是______________________________。
(3)溶液甲中的金属离子是_____________________(写离子符号)。
(4)步骤①②③中所发生的化学反应,其中属于置换反应的是________(填序号)。
(5)步骤③中发生反应的化学方程式是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C为中学常见单质,其中一种为金属;通常情况下,A为固体,B为易挥发液体,C为气体。
D、E、F、G、X均为化合物,其中X是一种无氧强酸、E为黑色固体,H在常温下为液体.它们之间的转化关系如图所示(其中某些反应条件和部分反应物已略去)。
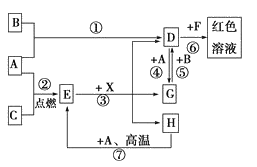
(1)写出化学式:A___,D___,E___,X___。
(2)在反应①~⑦中,不属于氧化还原反应的是____。(填编号)
(3)反应⑥的离子方程式为____。
(4)反应⑦的化学方程式为____。
(5)该反应中每消耗0.3mol的A,可转移电子___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用“双线桥”标出电子转移的方向和数目,并分别指出 氧化剂和氧化产物。
(1)Fe+CuSO4=FeSO4+Cu ________ 氧化剂是 ____________氧化产物是_____________,
(2)3CO+Fe2O3![]() 3CO2+2Fe ________ 氧化剂是 ____________氧化产物是_____________,
3CO2+2Fe ________ 氧化剂是 ____________氧化产物是_____________,
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com