
| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
分析 (1)根据平衡常数等于生成物浓度幂之积除以反应物浓度幂之积计算;
(2)温度升高平衡常数增大,说明平衡向正反应方向移动;
(3)根据化学平衡状态的特征-正逆反应速率相等进行判断.
解答 解:(1)平衡常数等于生成物浓度幂之积除以反应物浓度幂之积,则K=$\frac{[CO]•[{H}_{2}O]}{[C{O}_{2}]•[{H}_{2}]}$,故答案为:$\frac{[CO]•[{H}_{2}O]}{[C{O}_{2}]•[{H}_{2}]}$;
(2)温度升高平衡常数增大,说明平衡向正反应方向移动,则正反应为吸热反应,故答案为:吸热;
(3)a、因该反应为反应前后气体体积不变的反应,故容器中压强不变不能作为平衡状态的判据,故a错误;
b、c(CO)不变,说明各组分浓度都不变,反应达到平衡状态,故b正确;
c、H2消耗的速率与H2O消耗的速率相等,表明正逆反应速率相等,达到了平衡状态,故c正确;
d、二氧化碳和CO的浓度是否相等,与平衡状态无关,决定于开始加入的多少,故d错误;
故答案为:bc.
点评 本题考查了化学平衡状态的判断、化学平衡的影响因素,题目难度中等,根据化学平衡状态的特征判断是否达到平衡状态,注意外界条件对化学平衡的影响.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知冰的熔化热为6.0 kJ/mol,冰中氢键键能为20 kJ/mol,假设1 mol冰中有2 mol 氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15%的氢键 | |
| B. | 已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g),△H=+489.0 kJ/mol. CO(g)+$\frac{1}{2}$O2(g)═CO2(g),△H=-283.0 kJ/mol. C(石墨)+O2(g)═CO2(g),△H=-393.5 kJ/mol. 则4Fe(s)+3O2(g)═2Fe2O3(s),△H=-1641.0 kJ/mol | |
| C. | 实验测得环己烷(l)、环己烯(l)和苯(l)的标准燃烧热分别为-3916 kJ/mol、-3747 kJ/mol和-3265 kJ/mol,可以证明在苯分子中不存在独立的碳碳双键 | |
| D. | 已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为α,Ka=$\frac{{{{(cα)}^2}}}{c(1-α)}$.若加入少量醋酸钠固体,则CH3COOH?CH3COO-+H+向左移动,α减小,Ka变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
. .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
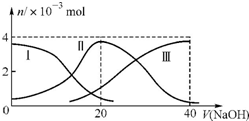 常温下,向20mL0.2mol/L H2C2O4溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化曲线如图所示,[已知CaC2O4难溶于水].根据图示判断,下列说法不正确的是( )
常温下,向20mL0.2mol/L H2C2O4溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化曲线如图所示,[已知CaC2O4难溶于水].根据图示判断,下列说法不正确的是( )| A. | 曲线Ⅱ代表的粒子是HC2O4- | |
| B. | 当V(NaOH)=20ml时,溶液中离子浓度的大小关系为:c(Na+)>c(HC2O4-)>c(C2O42-)>c(H+)>c(OH-) | |
| C. | NaH C2O4溶液中:c(OH-)+c(C2O42-)=c(H+)+c(H2C2O4) | |
| D. | 向NaHC2O4溶液中逐渐加入CaCl2粉末并充分搅拌,溶液PH可能逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②③④ | C. | ①②④ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -8Q kJ•mol-1 | B. | -4Q kJ•mol-1 | C. | -20Q kJ•mol-1 | D. | -16Q kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝的化学性质不活泼 | |
| B. | 铝制容器既耐酸又耐碱 | |
| C. | 铝与氧气在常温下不反应 | |
| D. | 铝易被氧化,但氧化生成的氧化铝具有保护内层金属铝的作用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com