
| A. | 反应所生成的气体体积:a杯>b杯 | B. | 反应所需要的时间:a杯>b杯 | ||
| C. | 刚开始时反应的速率:b杯>a杯 | D. | 整个反应阶段平均速率:a杯>b杯 |
分析 pH相同的盐酸和醋酸,则反应开始时两种溶液中氢离子浓度相等,醋酸是弱电解质,氯化氢是强电解质,所以C(HCl)<C(CH3COOH),随反应进行,醋酸继续电离,醋酸溶液中氢离子浓度比盐酸中氢离子浓度大,反应速率和离子浓度成正比,若最后锌粒全部溶解则放出气体一样多,可能是盐酸恰好反应而醋酸过量,也可能是盐酸和醋酸都过量,以此解答该题.
解答 解:A、若最后锌粒全部溶解则放出气体一样多,故A错误;
B、pH相同的盐酸和醋酸,则反应开始时两种溶液中氢离子浓度相等,醋酸是弱电解质,氯化氢是强电解质,所以C(HCl)<C(CH3COOH),随反应进行,醋酸继续电离,醋酸溶液中氢离子浓度比盐酸中氢离子浓度大,反应速率和离子浓度成正比,所以反应所需要的时间:a杯>b杯,故B正确;
C、pH相同的盐酸和醋酸,则反应开始时两种溶液中氢离子浓度相等,反应速率相同,故B错误;
D、pH相同的盐酸和醋酸,则反应开始时两种溶液中氢离子浓度相等,醋酸是弱电解质,氯化氢是强电解质,所以C(HCl)<C(CH3COOH),随反应进行,醋酸继续电离,醋酸溶液中氢离子浓度比盐酸中氢离子浓度大,反应速率和离子浓度成正比,所以整个反应阶段平均速率:a杯<b杯,故D错误;
故选B.
点评 本题考查弱电解质的电离,结合影响化学反应速率的因素综合考查学生的分析能力,为高频考点,注意把握弱电解质的电离特点,难度不大.


科目:高中化学 来源: 题型:解答题
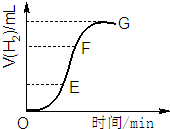 用不纯的锌粒与2mol/L盐酸反应制取氢气气体,请回答:
用不纯的锌粒与2mol/L盐酸反应制取氢气气体,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
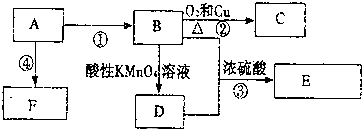
 ,F的结构简式
,F的结构简式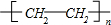 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
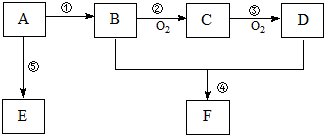
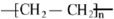 ,B中官能团的名称为羟基.
,B中官能团的名称为羟基. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
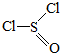 )主要用于制造酰基氯化物,其工业制备原理:
)主要用于制造酰基氯化物,其工业制备原理:| A. | SCl2和SOCl2中S的化合价分别为+2、+4价 | |
| B. | 制备反应中,二氧化硫是氧化产物 | |
| C. | 每消耗1mol SCl2,转移1mol电子 | |
| D. | SOCl2分子中既含有离子键又含有共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com