
| A. | 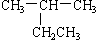 2-乙基丙烷 2-乙基丙烷 | B. | CH3CH2CH2CH2OH 4-丁醇 | ||
| C. | 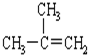 2-甲基-2-丙烯 2-甲基-2-丙烯 | D. | 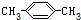 对二甲苯 对二甲苯 |
分析 A、烷烃命名时,要选择最长的碳链为主链,从离支链近的一端给主链上碳原子进行编号;
B、醇命名时,选含官能团的最长的碳链为主链,从离官能团近的一端给主链上碳原子编号;
C、烯烃命名时,选含官能团的最长的碳链为主链,从离官能团近的一端给主链上碳原子编号;
D、苯的同系物命名时,根据侧链的位置关系来分析.
解答 解:A、烷烃命名时,要选择最长的碳链为主链,故主链上有4个碳原子,故为丁烷,从离支链近的一端给主链上碳原子进行编号,故在2号碳原子上有一个甲基,故名称为2-甲基丁烷,故A错误;B、醇命名时,选含官能团的最长的碳链为主链,故主链上有4个碳原子,为丁醇,从离官能团近的一端给主链上碳原子编号,故在1号碳原子上有-OH,故为1-丁醇,故B错误;
C、烯烃命名时,选含官能团的最长的碳链为主链,故主链上有3个碳原子,为丙烯,从离官能团近的一端给主链上碳原子编号,故在1号和2号碳原子间有碳碳双键,在2号碳原子上有一个甲基,故名称为2-甲基-1丙烯,故C错误;
D、此有机物中,两个甲基位于苯环的对位关系,故为对二甲苯,故D正确.
故选D.
点评 本题考查了烷烃、烯烃、醇和苯的同系物的命名,难度不大,应注意的是含官能团的有机物在命名时,要选含官能团的最长碳链为主链.


科目:高中化学 来源: 题型:解答题
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度 (10-3mol•L-1) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3BH3中H元素均为+1价 | |
| B. | 合成反应中每生成1 mol NH3BH3会转移2 mol e- | |
| C. | 两个反应中,H2均既是氧化产物,又是还原产物 | |
| D. | 0.1 mol NH3BH3发生上述催化脱氢反应,一定生成6.72 L H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当达到化学平衡时,反应物已完全转化为生成物 | |
| B. | 化学平衡是一定条件下的平衡,当条件改变时,平衡可能会遭到破坏 | |
| C. | 当达到化学平衡时,反应混合物中各成分的浓度相等 | |
| D. | 当达到化学平衡时,正逆反应均已停止 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
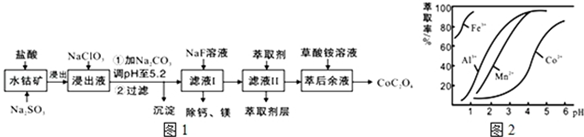
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
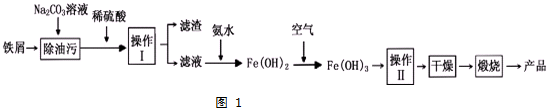
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池工作时,有机阳离子通过外电路移向石墨电极 | |
| B. | 若用该电池给钢制品表面电镀Al,则钢制品应该接电池的正极 | |
| C. | 电池充电时,阴极的电极反应式为4Al2Cl7-+3e-=Al+7AlCl4- | |
| D. | 若改用NaOH溶液作电解液,则Al电极的反应式为Al-3e-+3OH-=Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
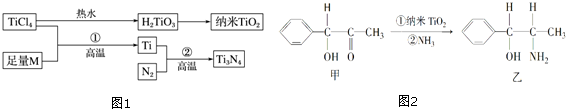
| I1 | I2 | I3 | I4 | I5 | |
| 电离能/kJ•mol-1 | 738 | 1 451 | 7 733 | 10 540 | 13 630 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com