
����Ŀ����֪ͭ�������A���ṹ��ͼ������ش��������⣺
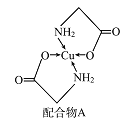
(1)Cu�ļ����Ų�ʽΪ______________ ��
(2)A��������Ԫ��C��N��O�ĵ�һ�������ɴ�С��˳��Ϊ_______________�����е�ԭ�ӵ��ӻ��������Ϊ________��
(3)���就�������(H2NCH2COO-)���ȷֽ�ɲ���CO2��N2��N2��������������Ŀ֮��
��__________��N2O��CO2��Ϊ�ȵ����壬��N2O������Oֻ��һ��N��������N2O�ĵ���ʽΪ_______��
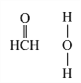
(4)��Cu���£��״��ɱ�����Ϊ��ȩ(HCHO)����ȩ������H CO�ļ���___________��ѡ������������������������С������120������ȩ����ˮ�γ������������ͼ�б�ʾ����___________��
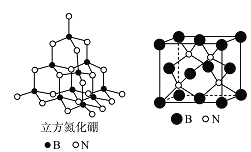
(5)������������ͼ������ʯ�ṹ���ƣ��dz�Ӳ���ϡ���������������B-N��������ԭ����֮��Ϊ___________���ṹ��ѧ����ԭ�����������ʾ�����ڲ���ԭ�ӵ����λ�ã���ͼ���ң�����������ľ����У�Bԭ�ӵ���������ֱ��У�
![]() �ȡ��������������Bԭ������ҵȾ��Nԭ�ӵ��������Ϊ____________________ ��
�ȡ��������������Bԭ������ҵȾ��Nԭ�ӵ��������Ϊ____________________ ��
���𰸡� [Ar]3d104S1 N>O>C SP3�ӻ� 1��2 ![]() ����
����  4��1 ��1/4��1/4��1/4 ��
4��1 ��1/4��1/4��1/4 ��
�����������⿼�����Ԫ��Cu���仯����Ľṹ�������Ų����ӻ����������ṹ�����ʽṹ���й�֪ʶ�㡣����Cu��ԭ�ӽṹ�͵����Ų����ɡ��ӻ���������ӹ��͵�֪ʶ�;���������Լ������й�֪ʶ�������⡣
��1����̬Cuԭ�Ӻ�����29�����ӣ���Χ�����Ų�ʽΪ3d104s1��ȫ�����ṹ���ȶ��������Ų�ʽΪ[Ar]3d104S1
��2��ͬ��������Ԫ�ش����ҵ�һ�����ܳ��������ƣ�����A��͵���A��Ԫ�ط�����Nԭ����Χ�����Ų�Ϊ2s22p3��Ϊ������ṹ�����ȶ���N�ĵ��������C��N��O�ĵ�һ�������ɴ�С��˳��ΪN��O��C����ԭ����4���ӻ����������Ϊ SP3�ӻ�
��3��N2�ĽṹʽΪN��N, ��1��������2������������������������Ŀ��Ϊ1:2��N2O��CO2��Ϊ�ȵ����壬��N2O������Oֻ��һ��N��������N2O�ṹ��CO2���ƣ�������ṹΪN=��=�ϣ�����ʽΪ![]()
��4����ȩ�����У�̼ԭ��Ϊ����ӻ������ӳ�ƽ�������ͣ�����Լ120����������ԭ���йµ��Ӷԣ�����ԭ�����ų����ã����ԣϣãȼ��ǻ��Դ���120�����ʻ����к�ǿ�ĵ縺�ԣ���H2O��H�н�ǿ�ľ��������������γ������
��5����ͼ��֪��һ��Bԭ����4��Nԭ���γ�4��B-N���ۼ���B-N��������ԭ����֮��Ϊ4:1�����ݸ���ԭ�ӵ����λ�ÿ�֪��������������Bԭ������ҵȾ��Nԭ����x��y��z�����������1/4����������������(![]() ��
�� ![]() ��
�� ![]() )
)



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʽΪC5H12O��������������Ʒ�Ӧ���л��������У������������칹��
A. 4�� B. 5�� C. 6�� D. 7��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й�����ϩ˵����ȷ����
A. ��ϩʹ���Ը��������Һ��������Ȼ�̼��Һ��ɫԭ����ͬ
B. ��ҵ������ϩˮ�������Ҵ����Ƿ�����ȡ����Ӧ
C. ˮ��������Ϊ�ӳ���ʵ�ij����ڣ����ڳ�������ý��ݹ����������Һ�Ĺ�����
D. ��ϩ�ڿ�����ȼ�գ�������������������Ũ�̵Ļ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ҩƷ��ʹ�ú���������˵����ȷ����
A��R��ʾ�Ǵ���ҩ��OTC��ʾ����ҩ
B����Ƽ��ǹ��ʰ�ί���ϸ��ֹʹ�õ��˷ܼ�
C����Ʒ�����ж���ҩƷ
D���ҹ�����ҽѧ����ʱ��������ҽѧ�����ǡ���ũ���ݾ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦA��g��+B��g��![]() C��g��+D��g�������е������仯��ͼ��ʾ���ش��������⣮
C��g��+D��g�������е������仯��ͼ��ʾ���ش��������⣮

��1���÷�Ӧ�� ��Ӧ��������������������������
��2������Ӧ�ﵽƽ��ʱ�������¶ȣ�A��ת���� ������������������С����������������ԭ����
��3����Ӧ��ϵ�м�������Է�Ӧ���Ƿ���Ӱ�죿 ����������������������ԭ���� ��
��4���ڷ�Ӧ��ϵ�м����������Ӧ��������E1��E2�ı仯�ǣ�E1 ��E2 ������������������С����������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ճ������г��������ӵ�ʳ�������������������߸�ţ������������Ҷ�������������������ʣ�����ĵ⡢�����ơ�������Ӧ����Ϊ
A. Ԫ�� B. ���� C. ���� D. ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ü�������������ȡ����Ӧ��ȡ����Ʒ����������ڹ�ҵ���ѳ�Ϊ��ʵ��ij��ѧ��ȤС������ʵ������ģ���������̣�����Ƶ�ģ��װ�����£�
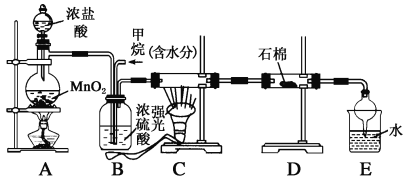
(1)Bװ�������ֹ��ܣ�
��__________����__________����__________��
(2)��V(Cl2)/V(CH4)��x��������������������Ȼ��⣬��xֵ��ȡֵ��ΧΪ__________��
(3)Dװ�õ�ʯ���о��Ȼ���KI��ĩ����������_____________��
(4)Eװ�õ�������__________��________(����)��
A���ռ����� B����������
C����ֹ���� D�������Ȼ���
(5)��Cװ���У�����һ��ʱ���ǿ�����䣬����Ӳ�ʲ������ڱ��к�ɫС�����������û�����ɫС�����Ļ�ѧ����ʽΪ__________���ɼ��л���Ӧ�кܶั��Ӧ��
(6)Eװ�ó����������⣬�����л����E�з�����������ѷ���Ϊ________(����)��
A����ȡ�� B������
C�����˷� D����Һ��
��װ�û���ȱ�ݣ�ԭ����û�н���β����������β������Ҫ�ɷ���__________��________(����)��
A��CH4 B��CH3Cl
C��CH2Cl2 D��CHCl3
E��CCl4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС��ͬѧΪ̽��ͬ���ڻ�ͬ����Ԫ�����ʵĵݱ���ɣ����������ϵ��ʵ�飺
��.��1�����������ļء��ơ�þ�����ֱ�Ͷ�뵽������ͬŨ�ȵ������У���Ԥ��ʵ���������������� �����ᷴӦ����ң� �����ᷴӦ���ɵ�������ࡣ
��2����Na2S��Һ��ͨ���������ֵ���ɫ���ǣ���֤��Cl�ķǽ����Ա�Sǿ����Ӧ�����ӷ���ʽΪ ��
��.������ͼװ������֤ͬ����Ԫ�طǽ����Եı仯���ɣ�
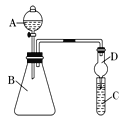
��1��Ҫ֤���ǽ����ԣ�Cl>I����A�м�Ũ���ᣬB�м�KMnO4(KMnO4��Ũ���᳣���·�Ӧ��������)��C�мӵ��۵⻯�ػ����Һ���۲쵽C����Һ ��������֤���������D�������� ���ӻ��������ĽǶȿ��ǣ���װ����ȱ��β������װ�ã����� ��Һ����β����
��2��Ҫ֤���ǽ����ԣ�C>Si����A�м����ᣬB�м�CaCO3��C�м�Na2SiO3��Һ�����۲쵽C�� ��������ʦ��Ϊ������������֤������ǿ����ϵΪ̼����ᣬ���������������� �����Ӧ��B��D֮������һ��ʢ������ (ѡ��������ĸ��A��Ũ���� B��ŨNaOH��ҺC������Na2CO3��Һ D������NaHCO3��Һ)��ϴ��װ�á��Ľ���C�з�����Ӧ�Ļ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��R��T��Q��W��Ԫ�����ڱ��е����λ����ͼ��ʾ������T������������������������ȡ������жϲ���ȷ����
![]()
A. �����̬�⻯������ȶ��ԣ�R��Q
B. ����������Ӧˮ��������ԣ�Q��W
C. ԭ�Ӱ뾶��T��Q��R
D. ��T������Һһ��������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com