
| 实验 编号 | 实验温度 /℃ | Na2S2O3 | H2SO4 | 蒸馏水体积 /mL | ||
| 体积/mL | 浓度/mol•L-1 | 体积/mL | 浓度/mol•L-1 | |||
| ① | 25 | 10 | 0.1 | 10 | 0.1 | 0 |
| ② | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
| ③ | 25 | 5 | 0.2 | 10 | 0.2 | 5 |
| ④ | 50 | 5 | 0.1 | 10 | 0.1 | 5 |
| ⑤ | 50 | 10 | 0.2 | 5 | 0.2 | 5 |

分析 I.A.实验①、②的温度相等,c(H2SO4)相等,c(Na2S2O3)不相等,故实验①、②是探究浓度对化学反应速率的影响;
B.实验①、③的温度相等,c(Na2S2O3)相等,c(H2SO4)不相等,反应速率不相等;
C.实验③、⑤温度不相等,c(H2SO4)和c(Na2S2O3)也均不相等;
D.采取控制变量法对比实验探究外界条件对反应速率的影响;
Ⅱ.(1)过滤除去不溶杂质,若温度冷却,硫化钠会结晶析出而损失;
(2)盛放Na2SO3固体的玻璃仪器是蒸馏烧瓶,三颈烧瓶内反应结束会有未反应的二氧化硫,直接排放会污染空气;
(3)①用配制的碘溶液滴定硫代硫酸钠,利用碘单质遇碘单质变蓝指示反应终点
②终点读数与起点读数之差为消耗碘的标准溶液体积,根据方程式计算
③局部变色就停止滴定,消耗标准溶液体积偏小,测定结果偏低.
解答 解:I.A.实验①、②的温度相等,c(H2SO4)相等,c(Na2S2O3)不相等,故实验①、②是探究浓度对化学反应速率的影响,故A正确;
B.实验①、③的温度相等,c(Na2S2O3)相等,c(H2SO4)不相等,③中c(H2SO4)较大,反应速率较快,变浑浊时间较短,故B错误;
C.探究温度对化学反应速率的影响,应保证物质的浓度相等,而实验③、⑤温度不相等,c(H2SO4)和c(Na2S2O3)也均不相等,实验②、④中c(H2SO4)和c(Na2S2O3)均相等,但温度不等,故实验②、④是探究温度对化学反应速率的影响,故C错误;
D.采取控制变量法对比实验探究外界条件对反应速率的影响,故D正确,
故选:AD;
Ⅱ.(1)过滤除去不溶杂质,若温度冷却,硫化钠会结晶析出而损失,
故答案为:防止硫化钠结晶析出而损失、去除杂质;
(2)盛放Na2SO3固体的玻璃仪器是蒸馏烧瓶,三颈烧瓶内反应结束会有未反应的二氧化硫,装置中氢氧化钠是吸收尾气的主要作用,因为原料气二氧化硫是污染性气体不能排放到空气中,以防止污染空气,
故答案为:蒸馏烧瓶;吸收SO2等尾气,防止污染;
(3)①用配制的碘溶液滴定硫代硫酸钠,滴入最后一滴碘的标准溶液,溶液变为蓝色,且30s内不恢复原色,说明反应到达终点,
故答案为:滴入最后一滴碘的标准溶液,溶液变为蓝色,且30s内不恢复原色;
②终点读数为18.10mL,起点读数为0.00mL,故消耗碘的标准溶液体积为18.10mL,
设Na2S2O3•5H2O的纯度为x,则:
2Na2S2O3•5H2O~2Na2S2O3~I2
2M g 1mol
Wxg 18.10×10-3L×0.1000 mol•L-1
故2M g:Wx g=1mol:18.10×10-3L×0.1000 mol•L-1
解得x=$\frac{0.362M}{W}$%,
故答案为:18.10;$\frac{0.362M}{W}$%;
③局部变色就停止滴定,消耗标准溶液体积偏小,会使样品中Na2S2O3•5H2O的纯度的测量结果偏低,
故答案为:偏低.
点评 本题属于拼合型题目,涉及探究温度和浓度对反应速率的影响、物质实验制备、氧化还原反应滴定等,是对学生综合能力的考查,难度中等.


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:解答题
 二甲醚(CH3OCH3)是一种清洁、高效、具有优良的环保性能的可燃物,被称为21世纪的新型能源.工业制备二甲醚的生产流程如图1:
二甲醚(CH3OCH3)是一种清洁、高效、具有优良的环保性能的可燃物,被称为21世纪的新型能源.工业制备二甲醚的生产流程如图1:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 准确量取24.00 mL的液体可选用量筒或滴定管 | |
| B. | 配制0.1000mol•L-1碳酸钠溶液时,将溶液转移到容量瓶中需用玻璃棒引流 | |
| C. | 用广泛pH试纸测得某溶液pH为3.5 | |
| D. | 高锰酸钾是一种常用的化学试剂,当高锰酸钾晶体结块时,应在研钵中用力研磨,以得到细小晶体,有利于加快反应或溶解的速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将饱和氯水滴到淀粉碘化钾试纸上,如果试纸先变蓝后变白,说明氯气具有氧化性和漂白性 | |
| B. | 向Na2S2O3稀溶液中加入稀硫酸,发生如下反应:S2O32-+2H+═SO2↑+S↓+H2O,利用产生浑浊的快慢或产生气泡的快慢可以测定该反应在不同条件下的反应速率 | |
| C. | 乙酸乙酯中少量乙醇杂质可加水除去,其原理与溴水中加四氯化碳萃取溴类似 | |
| D. | 将SO2通入品红溶液中,品红溶液褪色,加热褪色后的溶液,恢复红色,说明亚硫酸不稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将等体积、等物质的量浓度的HA(HA为弱酸)与NaA混合,所得混合液的酸碱性取决于Ka(HA)的大小 | |
| B. | CH3COOH 溶液加水稀释后,溶液中c(H+)/c(CH3COO-) 的值减小 | |
| C. | 某氨水的pH=a,某盐酸的pH=b,已知a+b=14,将上述氨水与盐酸等体积混合后,溶液中各种离子浓度的关系为c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| D. | 等物质的量的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)═c(HCO3-)+c(H2CO3)+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用高锰酸钾溶液滴定Na2SO3溶液至终点:滴入最后一滴高锰酸钾溶液,溶液恰好由紫色变为无色,且半分钟不变色 | |
| B. | 通常用产生气泡的快慢,比较不同条件下Na2S2O3溶液与稀硫酸反应速率 | |
| C. | 润洗酸式滴定管时应从滴定管上口加入3~5mL所要盛装的酸溶液,倾斜着转动滴定管,使液体润湿其内壁,再从下口放出,重复2~3次 | |
| D. | 用标准NaOH溶液滴定盐酸,滴定管尖嘴部分在滴定前无气泡,滴定终点时出现气泡,则测定结果将偏大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
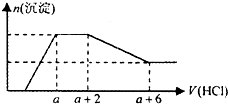 某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、HCO3-、Na+、Fe3+、Mg2+、Al3+等离子.当向该溶液中逐滴加入一定物质的量浓度的盐酸溶液时,发现生成沉淀的物质的量随盐酸溶液的体积变化的图象如图所示.下列说法正确的是( )
某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、HCO3-、Na+、Fe3+、Mg2+、Al3+等离子.当向该溶液中逐滴加入一定物质的量浓度的盐酸溶液时,发现生成沉淀的物质的量随盐酸溶液的体积变化的图象如图所示.下列说法正确的是( )| A. | 原溶液中一定含有的阴离子是:OH-、SiO32-、AlO2-、CO32- | |
| B. | 反应最后形成的溶液中的溶质只有NaCl | |
| C. | 原溶液中一定含有Na2SO4 和NaOH | |
| D. | 原溶液中含有CO32-与AlO2-的物质的量之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol任何气体的气体摩尔体积都约为22.4L/mol | |
| B. | 常温常压下,11.2LO3中所含氧原子个数等于1.5NA | |
| C. | 标准状况下,1mol CCl4所占的体积约为22.4L | |
| D. | 同温、同压下,相同体积的一氧化碳和二氧化碳的质量比为7:11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com