
| 容器 编号 | 起始时各物质的物质的量/mol | 达到平衡时体 系能量的变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出能量:23.15 kJ |
| ② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
| A、容器①、②中反应达到平衡时所用的时间相等 |
| B、平衡时,两个容器中NH3的体积分数均为12.5% |
| C、容器②中达到平衡时放出的热量Q=23.15 kJ |
| D、若容器①体积为0.2 L,则平衡时放出的热量>23.15 kJ |
| 2mol×23.15kJ |
| 92.6kJ |
 2NH3(g)△H=一92.6kJ/mol
2NH3(g)△H=一92.6kJ/mol| 0.5mol |
| 0.75mol+2.25mol+0.5mol |
| 1 |
| 7 |
| 1 |
| 7 |


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
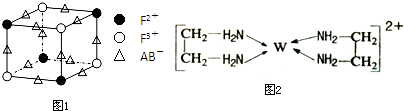 已知A、B、C、D、E、F、W都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素.A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子,W的+1价阳离子正好充满K,L,M三个电子层.回答下列问题:
已知A、B、C、D、E、F、W都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素.A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子,W的+1价阳离子正好充满K,L,M三个电子层.回答下列问题:| 1 |
| 8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol?L-1?min-1 |
| B、0.2mol?L-1?min-1 |
| C、0.9mol?L-1?min-1 |
| D、1.0mol?L-1?min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、15% | B、<15% |
| C、>15% | D、30% |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同一物质的固、液、气三种状态的熵相同 |
| B、0.1 mol铁在0.1 mol Cl2中充分燃烧,有0.3NA个电子转移 |
| C、等物质的量的钠分别在足量的氧气和氯气中燃烧,转移电子数相等 |
| D、1.5 mol NO2与足量H2O反应,转移的电子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com