
 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),到达平衡时,X、Y、Z的浓度分别为0.1mol?L-1、0.3mol?L-1、0.08mol?L-1,则下列判断不合理的是( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),到达平衡时,X、Y、Z的浓度分别为0.1mol?L-1、0.3mol?L-1、0.08mol?L-1,则下列判断不合理的是( ) 2Z(g)
2Z(g)

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
| A、2v逆(A2)=v正(B2) | B、反应中消耗2molA2同时生成2molC3 | C、容器内混合气体的密度保持不变 | D、容器内压强保持不变 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年河南省六市高三第二次联考化学试卷(解析版) 题型:填空题
氮元素的单质及其化合物的研究和应用在工农业生产中有着非常重要的地位。工业制硝酸的主要反应之一是
(1)如果将4mol NH3和5mol O2放入容器中,达到平衡时放出热量0.8akJ,则平衡时NH3的转化率为 。
(2)在一定条件下,容积固定的密闭容器中进行上述反应,NO的浓度与时间关系如图所示,则NO的a、b、c三点的反应速率v(a正)、v(b逆)、v(c正)的大小关系是 。

(3)t℃时,在容积固定的密闭容器中发生上述反应,容器内各物质的浓度如下表:

①第2min到第4mim,反应速率v(O2)= ;
②第2min时改变了条件,改变的条件可能是 (从所给选项中选择);
A.降低温度 B.增加了生成物 C.减小压强 D.使用了高效催化剂
③在与第4min相同的温度下,若起始向容器中加入NH3、O2、NO和H2O(g)的浓度都为2moI/L,则该反应 (填“正反应方向进行”、“逆反应方向进行”、“不移动”)。
(4)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。尿素(H2NCONH2)是一种非常重要的高氮化肥,在温度70—95℃时,工业尾气中的NO、NO2可以用尿素溶液吸收,将其转化为N2,尿素与NO、NO2三者等物质的量反应的化学方程式为 。
(5)目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:

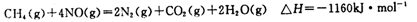
则1mol甲烷直接将NO2还原为N2的烩变为____ 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年山西省太原五中高一(下)期中化学试卷(解析版) 题型:选择题
 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),到达平衡时,X、Y、Z的浓度分别为0.1mol?L-1、0.3mol?L-1、0.08mol?L-1,则下列判断不合理的是( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),到达平衡时,X、Y、Z的浓度分别为0.1mol?L-1、0.3mol?L-1、0.08mol?L-1,则下列判断不合理的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,容积固定的密闭容器中,对于可逆反应X(g)+3Y(g) ![]() 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),到达平衡时,X、Y、Z的浓度分别为0.1mol·L-1、0.3mol·L-1 、0.08mol·L-1,则下列判断不合理的是
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),到达平衡时,X、Y、Z的浓度分别为0.1mol·L-1、0.3mol·L-1 、0.08mol·L-1,则下列判断不合理的是
A.c1:c2=1:3
B.平衡时,Y和Z的生成速率之比为2:3
C.达平衡时,容器内的压强不再变化
D.c1的取值范围为0<c1<0.14mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com