(2011?石景山区一模)我国制碱工业的先驱--侯德榜先生,1939年发明了著名的侯氏制碱法,其核心反应原理可用如下化学方程式表示:
NH
3+CO
2+NaCl+H
2O═NH
4Cl+NaHCO
3(晶体),依据此原理,欲制得碳酸氢钠晶体,某校学生设计了如下实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和.

(1)A装置中所发生反应的离子方程式为
CaCO3+2H+=Ca2++CO2↑+H2O
CaCO3+2H+=Ca2++CO2↑+H2O
.C装置中稀硫酸的作用为
吸收从B装置中的试管内逸出的氨气,减少对环境的污染
吸收从B装置中的试管内逸出的氨气,减少对环境的污染
.
(2)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100g水)
温度
溶解度
盐 |
0℃ |
10℃ |
20℃ |
30℃ |
40℃ |
50℃ |
| NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
| NaHCO3 |
6.9 |
8.1 |
9.6 |
11.1 |
12.7 |
14.5 |
| NH4Cl |
29.4 |
33.3 |
37.2 |
41.4 |
45.8 |
50.4 |
参照表中数据,请分析B装置中使用冰水的目的是
温度越低碳酸氢钠溶解度越小,便于析出
温度越低碳酸氢钠溶解度越小,便于析出
.
(3)该校学生在检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,指寻教师指出应在
AB
AB
装置之间(填写字母)连接一个盛有
饱和碳酸氢钠溶液的
饱和碳酸氢钠溶液的
的洗气装置,其作用是
除去二氧化碳气体中的氯化氢气体
除去二氧化碳气体中的氯化氢气体
.
(4)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85g,实验后得到干燥的NaHCO
3晶体的质量为5.04g,则NaHCO
3的产率为
60%
60%
.




 名校课堂系列答案
名校课堂系列答案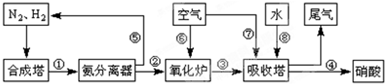
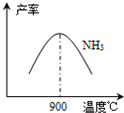 (3)N2和H2在铁作催化剂作用下从145℃就开始反应,不同温度下NH3产率如图所示.温度高于900℃时,NH3产率下降的原因
(3)N2和H2在铁作催化剂作用下从145℃就开始反应,不同温度下NH3产率如图所示.温度高于900℃时,NH3产率下降的原因