
| A. | 家用燃气灶是化学能转化为热能的应用装置 | |
| B. | 食品放入冰箱中,因为温度低,变质速率降低,所以食品能够保存较长时间 | |
| C. | 将煤气化,有利于提供更多的能量,而且有效地减少温室气体的产生 | |
| D. | 因为食用醋中含有酸,可以用来清洗锅垢 |
分析 A、物质的燃烧化学能转化为热能;
B、温度降低会减小腐蚀反应的速率;
C、将煤气化,不会改变燃烧过程的能量,根据盖斯定律来解释;
D、醋酸可以和水垢的成分之间发生反应.
解答 解:A、家用燃气是烃的燃烧过程,是化学能转化为热能的过程,故A正确;
B、温度降低会减小腐蚀反应的速率,放在冰箱中的食品保质期较长,这与温度对反应速率的影响有关,故B正确;
C、将煤气化,根据盖斯定律,将煤气化,不会改变燃烧过程的能量,故C错误;
D、醋酸可以和水垢的成分之间碳酸钙、氢氧化镁之间发生反应得到易溶于水的物质,所以食用醋可以用来清洗锅垢,故D正确.
故选C.
点评 本题是一道化学和生活的应用相结合题目,化学来源于生活、离不开生活,注意知识的迁移应用是关键,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
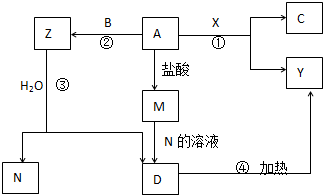 如图转化关系中,A、B、C为单质,其余方框内均为化合物,B、X、N常温下为气体,C为黑色固体,D为白色沉淀,A、Y、Z、M、D中均含同一种元素(框图中某些生成物已略去).请填写下列空白:
如图转化关系中,A、B、C为单质,其余方框内均为化合物,B、X、N常温下为气体,C为黑色固体,D为白色沉淀,A、Y、Z、M、D中均含同一种元素(框图中某些生成物已略去).请填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
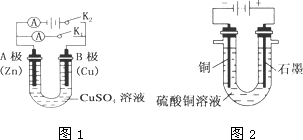 请按要求回答下列问题.
请按要求回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向盐酸中滴加氨水:H++OH-═H2O | |
| B. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 向Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O═2SO32-+4Cl-+6H+ | |
| D. | 铜溶于稀硝酸:3Cu+8H++2NO3-═3Cu2++2 NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和热测定实验时,如果没有环形玻璃搅拌棒,可用环形铜质搅拌棒代替 | |
| B. | 用pH试纸测定溶液的pH值时,先把试纸放在待测液中,然后比色 | |
| C. | 含NO2球放在热水中的平衡球颜色加深,放入冷水中的平衡球颜色变浅 | |
| D. | 向盛有FeCl3溶液的试管中加入KSCN溶液,立即生成血红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定温度下,反应 MgCl2(l)═Mg(l)+Cl2(g)的△H>0、△S>0 | |
| B. | 放热反应的反应速率总是大于吸热反应的反应速率 | |
| C. | 在H2S溶液中,C(H+)和C(S2-)的比值为2:1 | |
| D. | 1 mol/L和0.1 mol/L的两瓶氨水中c(OH-)之比为10:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
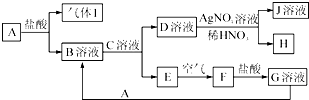 已知A~J都是中学化学中的常见物质,其中A、I为单质,E、H是白色沉淀,F为红褐色沉淀,J溶液的焰色反应(透过蓝色的钴玻璃观察)呈紫色,各物质之间的转化关系如图所示.
已知A~J都是中学化学中的常见物质,其中A、I为单质,E、H是白色沉淀,F为红褐色沉淀,J溶液的焰色反应(透过蓝色的钴玻璃观察)呈紫色,各物质之间的转化关系如图所示. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com