
| 元素编号 | 元素性质或原子结构 |
| T | 能形成双原子气体分子,原子中有三个单电子 |
| X | 核外有5个能级,最高能级上只有1个电子 |
| Y | 最外层电子数是次外层电子数2倍 |
| Z | 最高正价为+7价 |
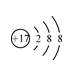 [Ar]3d6
[Ar]3d6 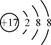 。地壳中含量仅次于Al的是铁,根据构造原理可知,该元素的+2价阳离子的电子排布式是[Ar]3d6。
。地壳中含量仅次于Al的是铁,根据构造原理可知,该元素的+2价阳离子的电子排布式是[Ar]3d6。

科目:高中化学 来源:不详 题型:填空题
 应条件略去)。
应条件略去)。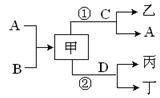
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
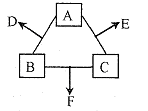
 是同主族元素,又知乙、丁两元素的原子核中质子数和是甲、丙原子核中质子数之和的2倍,甲元素的一种同位素核内无中子。
是同主族元素,又知乙、丁两元素的原子核中质子数和是甲、丙原子核中质子数之和的2倍,甲元素的一种同位素核内无中子。 。
。 。
。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.离子半径:Na+>N3->H+ | B.加热熔化时,都只破坏离子键 |
| C.与盐酸反应都只生成一种盐 | D.与水反应都是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
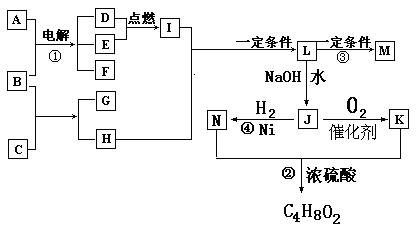
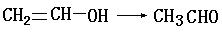
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com