
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
分析 有机物A的分子式为C4H10O,可能为醚,也可能为醇,若为醚,根据可能的烃基进行组合判断同分异构体,若为醇,看作丁烷中H原子被-OH确定,丁烷有正丁烷、异丁烷,利用等效氢判断丁醇同分异构体数目.
解答 解:有机物A的分子式为C4H10O,可能为醚,也可能为醇.
若为醚,可以是CH3OCH2CH2CH3、CH3OCH(CH3)2、CH3CH2OCH2CH3,
若为醇,看作丁烷中H原子被-OH确定,丁烷有正丁烷、异丁烷,分别有2种氢原子,可以得到4种醇,
故符合条件的同分异构体共有7种,
故选:D.
点评 本题考查同分异构体书写,侧重考查学生分析推理能力,注意利用取代法与等效氢确定丁醇同分异构体.


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:选择题
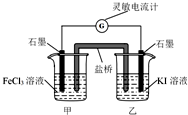
| A. | 反应开始时,乙中石墨电极上发生氧化反应 | |
| B. | 反应开始时,甲中石墨电极为正极 | |
| C. | 电流计读数为零时,反应达到化学平衡状态 | |
| D. | 电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
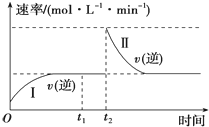 在一恒温恒压的密闭容器中发生如下反应:A(g)+B(g)?2C(g)△H<0,t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图所示.下列说法不正确的是( )
在一恒温恒压的密闭容器中发生如下反应:A(g)+B(g)?2C(g)△H<0,t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图所示.下列说法不正确的是( )| A. | 0~t2时,v(正)>v(逆) | |
| B. | Ⅰ、Ⅱ两过程达到平衡时,A的体积分数Ⅰ=Ⅱ | |
| C. | t2时刻改变的条件是向密闭容器中加C | |
| D. | Ⅰ、Ⅱ两过程达到平衡时,平衡常数K(Ⅰ)=K(Ⅱ) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
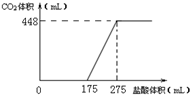
| A. | HCl的浓度0.2mol/L | |
| B. | 反应后固体的成分为NaOH与Na2CO3 | |
| C. | 密闭容器中排出气体的成分为O2和H2O | |
| D. | x的数值为6.09 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯元素的近似相对原子质量为35 | B. | 氯元素的某种同位素的质量数为35 | ||
| C. | 氯元素的中子数为18 | D. | 氯原子的质量为34.969 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
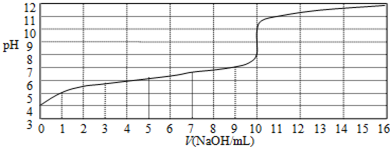
| A. | 此实验可以选用甲基橙作指示剂 | |
| B. | 该酸HA的浓度约为1×10-4mol/L | |
| C. | 当NaOH体积为9 mL时,恰好完全中和反应 | |
| D. | 达到滴定终点时,溶液中c(Na+)>c (A-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
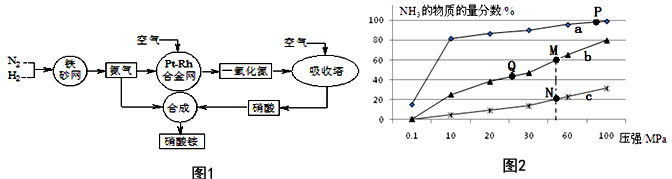
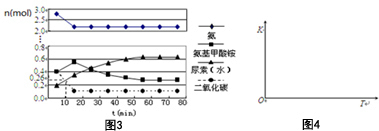
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com