

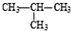
 )和双氧水为原料生产过氧化苯甲酰,写出合成过氧化苯甲酰的化学反应方程式:
)和双氧水为原料生产过氧化苯甲酰,写出合成过氧化苯甲酰的化学反应方程式: ,该反应属于取代反应.
,该反应属于取代反应.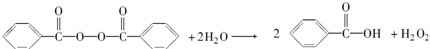 .苯甲酸的同分异构体中,属于酯类的有
.苯甲酸的同分异构体中,属于酯类的有 ,属于酚类的有3.(写结构简式)
,属于酚类的有3.(写结构简式) 分析 (1)由结构简式可知分子式,分子结构对称,含3种位置的H;
(2) 和双氧水反应生成
和双氧水反应生成 和HCl,-Cl被取代;
和HCl,-Cl被取代;
(3)苯甲酸的同分异构体中,含苯环且属于酯类,则苯环与-OOCH相连;苯甲酸的属于酚类结构的同分异构体为甲基苯酚.
解答 解:(1)由结构简式可知分子式为C14H10O4,分子结构对称,含3种位置的H,则一氯代物共有3种,故答案为:C14H10O4;3;
(2) 和双氧水反应生成
和双氧水反应生成 和HCl,该反应为
和HCl,该反应为 ,-Cl被取代,属于取代反应,
,-Cl被取代,属于取代反应,
故答案为: ;取代;
;取代;
(3)苯甲酸的同分异构体中,含苯环且属于酯类,则苯环与-OOCH相连,结构简式为 ,苯甲酸的属于酚类结构的同分异构体为甲基苯酚,有邻间对3种,故答案为:
,苯甲酸的属于酚类结构的同分异构体为甲基苯酚,有邻间对3种,故答案为: ;3.
;3.
点评 本题考查有机物结构和性质,为高频考点,侧重考查学生分析判断及应用能力,题目难度不大,明确官能团及其性质关系是解本题关键,难点是同分异构体种类判断,知道常见有机反应类型及其区别.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 和
和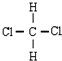
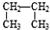 和
和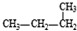
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
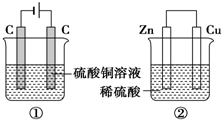 如图两个装置,工作时转移的电子数相等,反应完成后往①中加入9.8gCu(OH)2固体,溶液恰好能回复原浓度和体积.若忽略溶液体积的变化,下列叙述正确的是( )
如图两个装置,工作时转移的电子数相等,反应完成后往①中加入9.8gCu(OH)2固体,溶液恰好能回复原浓度和体积.若忽略溶液体积的变化,下列叙述正确的是( )| A. | 产生气体体积 ①=② | |
| B. | ①中阴极质量增加,②中正极质量减小 | |
| C. | 电极反应式:①中阴极:Cu2++2e-═Cu②中正极:2H++2e-═H2↑ | |
| D. | 反应完成后溶液PH:①<7,②>7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 卤素单质的密度逐渐增大 | |
| B. | 它们的氢化物的稳定性随核电荷数的增加而增强 | |
| C. | 将氯水加到KI淀粉溶液中,溶液变蓝 | |
| D. | 它们的原子核外电子层数随核电荷数的增加而增多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
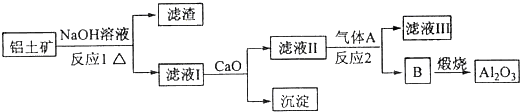
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com