
下列说法中正确的是
A.组成上相差一个或若干个CH2原子团,且符合同一通式的有机物之间互称为同系物
B.由于苯分子结构的特殊性,因此苯不能发生加成反应
C.将少量钠单质放入到含40%乙醇的饮用白酒中,不能验证钠可以和乙醇反应生成氢气,
D.丙烷分子中所有原子不在一个平面上,但3个碳原子在一直线上
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
已知1~18号元素的离子,aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是
A.质子数c>d
B.离子的还原性Y2->Z-
C.氢化物的稳定性H2Y>HZ
D.原子半径X<W
查看答案和解析>>
科目:高中化学 来源: 题型:
下列除杂质的操作中不正确的是
A.铁粉中混有铝粉:加入过量烧碱溶液充分反应后过滤
B.FeCl2溶液中混有FeCl3:加入过量铁粉充分反应后过滤
C.Na2CO3固体中混有少量NaHCO3:加入适量NaOH溶液
D.氯气中混有少量氯化氢气体:将混合气体通过盛饱和食盐水的洗气瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
①最外层电子数是2的元素一定是金属元素
②元素周期表中,非金属性最强的元素是F
③盐酸是强酸,H2S是弱酸,故非金属性:Cl>S
④X元素的阳离子和Y元素的阴离子具有相同的电子层结构,则原子序数:X>Y
⑤O2和O3属于同素异形体,故它们的性质相同
⑥H2O稳定的原因是水分子间存在氢键
A.①④⑥ B.①③⑤ C.①③⑤⑥ D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物的结构简式如右图,该物质不应有的化学性质是
①可燃烧;②可跟溴加成;③可使酸性KMnO4溶液褪色;
④可跟NaHCO3溶液反应;⑤可跟NaOH溶液反应;
⑥可在碱性条件下水解
A.①③ B.③⑥ C.④⑤ D.⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2
已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2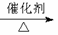 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
回答下列问题:
(1)写出A的电子式 。
(2)B、D分子中的官能团名称分别是 、 。
(3)写出下列反应的反应类型:① ,② ,④ 。
(4)写出下列反应的化学方程式:
② ;④ 。
(5)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法。
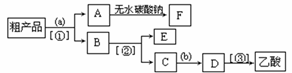

(Ⅰ)试剂a是__________,试剂b是_______________;
分离方法①是_________________,分离方法②是__________________,
分离方法③是_______________。
(Ⅱ)写出C → D 反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定。
Ⅰ.制备Na2S2O3·5H2O
反应原理:Na2SO3(aq)+S(s)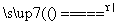 Na2S2O3(aq)
Na2S2O3(aq)
实验步骤:
①称取15 g Na2SO3加入圆底烧瓶中,再加入80 mL蒸馏水。另取5 g研细的硫粉,用3 mL乙醇润湿,加入上述溶液中。
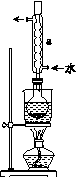
②安装实验装置(如图所示,部分夹持装置略去),水浴加热,微沸60 min。
③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3·5H2O,经过滤、洗涤、干燥,得到产品。
回答问题:
(1)硫粉在反应前用乙醇润湿的目的是__________________________。
(2)仪器a的名称是________,其作用是____________________。
(3)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是______________。检验是否存在该杂质的方法是____________________________。
(4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子反应方程式表示其原因:________________________________________________________________________
________________________________________________________________________。
Ⅱ.测定产品纯度
准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0 mol·L-1碘的标准溶液滴定。
反应原理为2S2O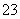 +I2===S4O
+I2===S4O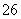 +2I-
+2I-
(5)滴定至终点时,溶液颜色的变化:____________________________________________。
(6)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为__________mL。产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)______________。
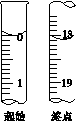
Ⅲ.Na2S2O3的应用
(7)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO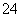 ,常用作脱氯剂,该反应的离子方程式为____________________________________________。
,常用作脱氯剂,该反应的离子方程式为____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com