
分析 首先明确弱电解质的电离程度和盐类水解程度一般比较小,从弱电解质的电离和盐类的水解的角度分析.
解答 解:可分3种情况讨论:(1)氨水电离产生NH4+、OH-,一水合氨电离程度很小;(2)NH4+水解产生H+及剩余NH4+;(3)NH4+水解受到影响,促进或抑制;在分析时要注意两点:氨水电离程度较小,NH4+水解程度也较小;另外,NH4HSO4溶液中,H+抑制NH4+水解,而NH4HCO3中,HCO3-比氨水更弱,HCO3-水解呈碱性,会促进NH4+水解,(NH4)2SO4中含有2个铵根离子,所以(NH4)2SO4中NH4+的浓度最大;所以,NH4+的浓度由大到小顺序为(NH4)2SO4、NH4HSO4、NH4Cl、NH4HCO3、NH3•H2O,
故答案为:⑤>④>②>③>①.
点评 本题考查了通过弱电解质的电离和盐类水解比较离子浓度的大小,题目难度不大,注意弱电解质的电离程度和盐类水解程度一般比较小.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案科目:高中化学 来源: 题型:解答题

| 物质 | 价格/元?吨-1 |
| 漂液(含25.2%NaClO) | 450 |
| 双氧水(含30%H2O2) | 2400 |
| 烧碱(含98%NaOH) | 2100 |
| 纯碱(含99.5%Na2CO3) | 600 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
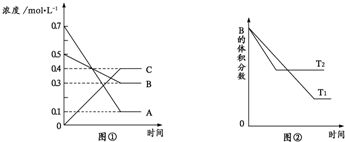
| A. | 该反应的化学方程式是A+3B═2C | |
| B. | 该反应的正反应为放热反应 | |
| C. | 定容条件下,混合气体的密度不再变化,则证明该反应达到平衡 | |
| D. | 压强增大,则该反应的正反应速率增大,逆反应速率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水中:C (Cl2)=2[C (ClO-)+C (Cl-)+C (HClO)] | |
| B. | 氯水中:c(C l-)>C (H+)>C (OH-)>C (ClO-) | |
| C. | 等体积等浓度的氢氧化钠与醋酸混合:C (Na+)=C (CH3COO-) | |
| D. | Na2CO3溶液中:C (Na+)>C (CO${\;}_{3}^{2-}$)>C (OH-)>C (HCO${\;}_{3}^{-}$)>C (H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液的质量分数为7.8% | B. | 溶液中溶质的质量大于7.8g | ||
| C. | 溶液中水的质量等于92.2g | D. | 溶液的质量等于100g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2 | B. | N2O | C. | NO | D. | NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com