
分析 Ⅰ.(1)探究温度对反应速率的影响,升高温度可加快反应速率;
(2)提供催化剂,加快反应速率,现象更为明显;
(3)只有一支试管中加入了氯化铁溶液,与另一支试管形成对比试验,探究催化剂对化学反应速率的影响;加入的1mL溶液会对B试管溶液进行稀释,使浓度发生改变;
Ⅱ.保证镁带完全一样,放在两只大小一致的试管中,加入相同体积不同浓度的硫酸溶液,保证相同温度,记录开始反应至结束所需的时间.
解答 解:(1)A、B两支试管中加入5mL5%H2O2溶液,B中的温度比A高,故试管B中产生气泡的速率快,说明升高温度可加快H2O2的分解速率,故答案为:B;升高温度可加快H2O2的分解速率;
(2)再同时向试管A和B中加入1mL1mol/L的FeCl3溶液,作为催化剂,加快反应速率,现象更为明显,故答案为:再同时向试管A和B中加入1mL1mol/L的FeCl3溶液;
(3)只有一支试管中加入了氯化铁溶液,与另一支试管形成对比试验,探究催化剂对化学反应速率的影响;但此方案设计不合理,因为加入的1mL溶液会对B试管溶液进行稀释,使浓度发生改变,故答案为:探究催化剂对化学反应速率的影响;否;
试管B中加入1mL的FeCl3溶液会使H2O2的浓度降低;
Ⅱ.保证镁带完全一样,放在两只大小一致的试管中,加入相同体积不同浓度的硫酸溶液,保证相同温度,记录开始反应至结束所需的时间,方案如下:
①取两支试管,向其中一支试管加入4mL1.0mol/L稀硫酸,另一支试管加入2mL 1.0mol/L稀硫酸和2mL蒸馏水,振荡混匀,将两支试管置于恒温水浴中;
②剪取长度相同的用砂纸打磨过的2段镁带;
③将两段镁带分别置于两支试管中,并用秒表记录镁带从投入到消失所需要的时间,
故答案为:①取两支试管,向其中一支试管加入4mL1.0mol/L稀硫酸,另一支试管加入2mL 1.0mol/L稀硫酸和2mL蒸馏水,振荡混匀,将两支试管置于恒温水浴中;
②剪取长度相同的用砂纸打磨过的2段镁带;
③将两段镁带分别置于两支试管中,并用秒表记录镁带从投入到消失所需要的时间.
点评 本题考查了探究影响反应速率的因素,实验方案的设计,难度一般,注意试验过程中单一变量研究方法的使用,为易错点.


科目:高中化学 来源: 题型:填空题
 CH3COOCH2CH3+H2O;苯制取环己烷:
CH3COOCH2CH3+H2O;苯制取环己烷: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
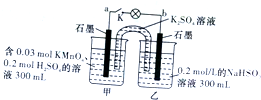
| A. | 电池工作时,甲烧杯中由烧杯中由水电离出的c(H+)逐渐减小 | |
| B. | 电池工作时,盐桥中的“K+”移向甲烧杯,外电路的方向是从b到a | |
| C. | 当电路中有1.204×1021个电子转移时,乙烧杯中溶液的pH约为2 | |
| D. | 乙池中的氧化产物为SO${\;}_{4}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验序号 | 实验内容 | 实验结果 |
| a | 加AgNO3溶液 | 有白色沉淀生成 |
| b | 加足量NaOH溶液并加热 | 收集到气体1.12 L(已折算成标准状况下的体积) |
| c | 加足量BaCl2溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量读数为6.27 g,第二次称量读数为2.33 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 64g | B. | 32g | C. | 64g•mol-1 | D. | 32g•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| a(干燥气体) | b(液体) |  | |
| A | NO | 水 | |
| B | CO2 | 4mol•L-1NaOH溶液 | |
| C | Cl2 | 饱和NaCl溶液 | |
| D | NH3 | 热的浓的NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1.12L氦气所含原子数为0.1NA | |
| B. | 1.6gNH2-离子所含质子数为NA | |
| C. | 22.4 LHCl溶于水,溶液中H+数为NA | |
| D. | 9g D216O所含的中子数为4.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④<⑤<①<②<③ | B. | ⑤<④<③<②<① | C. | ①<②<④<③<⑤ | D. | ①<②<③<④<⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com