
某铁合金与铁的物理性质的比较如下表所示:
熔点(℃) | 密度(g /cm3) | 硬度(金刚石为10) | 导电性(银为100) | |
某铁合金 | 2500 | 3.00 | 7.4 | 2.3 |
铁 | 1535 | 7.86 | 4.5 | 17 |
又知该铁合金耐腐蚀,强度大。从以上性能看,该铁合金不适合用作( )
A.导线 B.门窗框 C.炉具 D.飞机外壳
 综合自测系列答案
综合自测系列答案科目:高中化学 来源:2015-2016学年湖北省高一下期末化学试卷(解析版) 题型:实验题
实验室制备硝基苯的反应原理和实验装置如下:
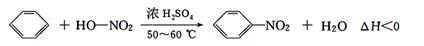
存在的主要副反应有:在温度稍高的情况下会生成间二硝基苯,有关数据如表:
物质 | 熔点/℃ | 沸点/℃ | 密度/ g·cm-3 | 溶解性 |
苯 | 5.5 | 80 | 0.88 | 微溶于水 |
硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
间二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
浓硝酸 |
| 83 | 1.4 | 易溶于水 |
浓硫酸 |
| 338 | 1.84 | 易溶于水 |
实验步骤如下:
取100 mL烧杯,用20 mL浓硫酸与18 mL浓硝酸配制混合液,将混合酸小心加入B中,把17.73 mL(15.6 g)苯加入A中。向室温下的苯中逐滴加入混酸,边滴边搅拌,混合均匀,在50~60 ℃下发生反应,直至反应结束。
将反应液冷却至室温后倒入分液漏斗中,依次用少量水、5% NaOH溶液和水洗涤。分出的产物加入无水CaCl2颗粒,静置片刻,弃去CaCl2,进行蒸馏纯化,收集205~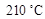 馏分,得到纯硝酸基苯18.45 g。回答下列问题:
馏分,得到纯硝酸基苯18.45 g。回答下列问题:
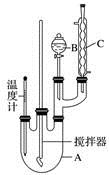
(1)装置B的名称是________,装置C的作用是____________________;
(2)配制混合液时,________(填“能”或“不能”)将浓硝酸加入到浓硫酸中,说明理由:________________________________________________________________________;
(3)为了使反应在50~60 ℃下进行,常用的方法是____________;
(4)在洗涤操作中,第二次水洗的作用是______________________________________;
(5)本实验所得到的硝基苯产率是_________________(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省高二下期末化学试卷(解析版) 题型:填空题
铜及其化合物在工业上有许多用途。回答下列问题:
(1)某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:

①浸取反应中氧化剂的化学式为_______;滤渣Ⅰ的成分为MnO2、S和_________(写化学式)。
②“除铁”这一步反应在25℃进行,加入试剂A调节溶液PH为4后,溶液中铜离子最大浓度不超过__________mol/L。(已知Ksp[Cu(OH)2]=2.2×10-20)
③“沉锰”(除Mn2+)过程中反应的离子方程式__________________________ 。
④ 滤液Ⅱ经蒸发结晶得到的盐主要是____________________ (写化学式)。
(2)某实验小组同学用电化学原理模拟湿法炼铜,进行了一系列探究活动。
①如下左图为某实验小组设计的原电池装置,盐桥内装载的是足量用饱和氯化钾溶液浸泡的琼脂,反应前,电极质量相等,一段时间后,两电极质量相差6.00 g,则导线中通过了________mol电子,若不考虑甲、乙两池电解质溶液中的离子向盐桥中移动,则甲、乙两池电解质溶液的总质量与实验开始前的电解质溶液的总 质量相差__________g
质量相差__________g

②其他条件不变,若将盐桥换成光亮的U形弯铜丝浸入甲池与乙池,如上右图所示,电流计指针偏转方向与先前一样,但偏转角度明显减小。一段时间后,乙池石墨棒浸入液面以下部分也析出了一层紫红色固体,则甲池铜丝附近溶液的pH________(填“减小”、“增大”或“不变”) ,乙池中石墨为________极(填“正”、“负”、“阴”或“阳”)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省高二下期末化学试卷(解析版) 题型:选择题
化学在生产和日常生活中有着重要的应用。下列说法正确的是( )
A.用米汤检验含碘盐中的碘元素
B.烧碱、小苏打、氢氧化铝均可用于治疗胃酸过多
C.工业生产中,常将氯气通入澄清石灰水中,制取漂白粉
D.除去CuSO4溶液中的Fe2(SO4)3,加入足量CuO粉末,充分搅拌过滤
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽师大附中高一下期末化学试卷(解析版) 题型:选择题
某温度下,将Cl2通入NaOH溶液中,反应得到NaClO、NaClO3的混合液,经测定ClO-和ClO3-的浓度之比为1∶3,则Cl2与NaOH溶液反应时被还原的氯原子与被氧化的氯原子的物质的量之比( )
A. 21∶5 B.11∶3 C.3∶1 D.4∶1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽师大附中高一下期末化学试卷(解析版) 题型:选择题
下列反应发生后,溶液中H+浓度未出现显著增大的是( )
①将SO2通入溴水中
②将SO2通入品红溶液中
③将H2S通入CuSO4溶液中
④将Cl2通入KI溶液
A.①② B.②④ C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二下期末化学试卷(解析版) 题型:计算题
25℃时,向100mL含氯化氢14.6g的盐酸里放入5.6g纯铁粉(不考虑反应前后溶液体积的变化),反映开始至2min末收集到氢气1.12L(标准状况),在此之后,又经过4min铁粉全部溶解。则:
(1)在前2min内用FeCl2表示的平均反应速率是多少?
(2)在后4min内用HCl表示的平均反应速率是多少?
(3)前2min与后4min相比,反应速率哪个较快?为什么?
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二下期末化学试卷(解析版) 题型:选择题
下列叙述正确的选项是
A.对于一定条件下的某一可逆反应,用平衡浓度表示的平衡常数和用平衡分压表示的平衡常数,其数值不同,但意义相同,都随温度的升高而增大。
B.结构式为 的物质互为同分异构体
的物质互为同分异构体
C.根据反应:NaA+CO2(少量)+ H2O==HA+NaHCO3 ; 2NaB+CO2+H2O== 2HB+Na2CO3,可以得出酸的强弱的顺序为:H2CO3 > HA> HCO3 — > HB
D.过硼酸钠晶体(NaBO3·4H2O)是一种优良的漂白剂,在70℃以上加热该晶体30.80克,反应后称量固体质量为27.20克,则该固体物质的化学式为NaBO3.H2O。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高二下期末化学试卷(解析版) 题型:选择题
乌洛托品在合成、医药、染料等工业中有广泛用途,其结构式如图所示、将甲醛水溶液与氨水混合蒸发可制得乌洛托品,若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比应为

A.1:1 B.2:3 C.3:2 D.2:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com