
| 元素 | X | Y | Z | W |
| 原子半径/nm | 0.186 | 0.074 | 0.102 | 0.077 |
| 主要化合价 | +1 | -2 | -2,+6 | -4,+4 |
| ||
| ||
| ||
| ||
| 5.75 |
| 23 |
| 8 |
| 16 |
| 4 |
| 32 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


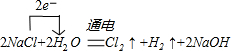
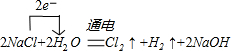
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)现有X.Y.Z.W四种常见的含氧酸,其成酸元素分属周期表中短周期的第ⅣA族到第 ⅦA。将四种含氧酸溶液分别进行光照或微热测得如下数据(其中Q为不确定的物质):
| 含氧酸 | X | Y | Z | W |
| 含氧酸质量/g | 25.2 | a | 3.1 | 10.5 |
| 生成物U/g | 3.2 | / | / | 3.2 |
| 生成物V/g | 3.6 | 0.9 | 0.9 | / |
| 生成物Q/g | 18.4 | 3.2 | b | c |
根据中学所学知识回答下列问题:
(1)上表中含氧酸名称:Z ,W ,生成物名称:U ,V 。
(2)上表中数据:a为 ,b为 ,c为 。
(3)将X的稀溶液加入Y中,反应的离子方程式是 。
(4)对W的水溶液光照一段时间后,溶液的pH (填“增大”.“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2010年郑州市高二下学期期末考试化学试题 题型:填空题
现有X、Y、Z、W四种短周期元素。
①X元素的单质在Y元素的单质中燃烧发出苍白色火焰,并生成气体A。
②Z元素的单质与A的水溶液反应又生成X元素的单质。
③Z元素的原子和Y元素的原子电子层数相同,且它们的最外层电子数之差的绝对值为奇数。
④W元素的原子核外有3个电子层,其最外层电子数等于电子层数。
请回答下列问题:
(1)X的元素符号为:_________;Z的元素名称是: 。(2分)
(2)A的电子式是 。(2分)
(3)Z的单质与A的溶液反应的离子方程式 。(2分)
(4)W的氧化物溶于NaOH中的化学方程式 。(2分)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com