
下列设计的实验方案能达到实验目的的是
A.工业上制取漂白粉:向澄清石灰水中通入足量的Cl2
B.验证醋酸是弱电解质:常温下测定0.1 mol·L-1醋酸或醋酸钠溶液的pH
C.探究FeCl3和KI溶液反应限度:向5mL0.1 mol·L-1KI溶液中加入0.1 mol·L-1FeCl3溶液1mL,振荡,加苯萃取后,向水层中加入5滴KSCN溶液,观察实验现象
D.检验蔗糖水解生成的葡萄糖:蔗糖溶液在稀硫酸存在下水浴加热一段时间后,再与银氨溶液混合加热,观察实验现象
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016届河南省南阳市高三上学期期中质量评估化学试卷(解析版) 题型:填空题
铈、铬、钛、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用。
(1)二氧化铈(CeO2)在平板电视显示屏中有着重要应用。CeO2在稀硫酸和H2O2的作用下可生成Ce3+,CeO2在该反应中作__________剂。
(2)自然界Cr主要以+3价和+6价存在。+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为+3价的铬。完成并配平下列离子方程式:
____Cr2O72-+___SO32-+___ =___Cr3++___SO42-+_______H2O
=___Cr3++___SO42-+_______H2O
(3)钛(Ti)被誉为“二十一世纪的金属”,工业上在550℃时用钠与四氯化钛反应可制得钛,该反应的化学方程式是____ 。
(4)NiSO4·xH2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得。操作步骤如下:
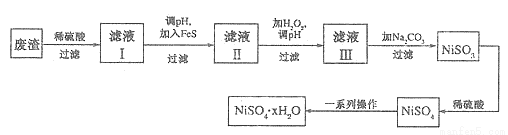
①向滤液I中加入FeS是为了除去Cu2+、Zn2+等杂质,除去Cu2+的离子方程式为_____________。
②对滤液Ⅱ先加H2O2再调pH,调pH的目的是_____________。
③滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是__________。
④为测定NiSO4·xH2O晶体中x的值,称取26.3g晶体加热至完全失去结晶水,剩余固体15.5g,则x的值等于__________ 。
查看答案和解析>>
科目:高中化学 来源:2016届江苏省南通市高三上学期第一次阶段测化学试卷(解析版) 题型:填空题
硫化氢的转化是资源利用和环境保护的重要研究课题。由硫化氢获得硫单质有多种方法。
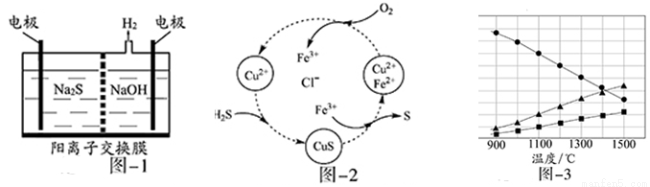
(1)将烧碱吸收H2S后的溶液加入到如图—1所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应:S2-—2e- S (n—1)S+ S2-
S (n—1)S+ S2- Sn2-
Sn2-
①写出电解时阴极的电极反应式:
②电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成
(2)将H2S和空气的混合气体通入FeCl3 、FeCl2 、CuCl2的混合溶液中反应回收S,其物质转化如图—2所示。
①在图示的转化中,化合价不变的元素是
②反应中当有1molH2S转化为硫单质时,保持溶液中Fe3+的物质的量不变,需要消耗O2的物质的量为
③在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有
(3)H2S在高温下分解生成硫蒸气和H2。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图—3所示,H2S在高温下分解反应的化学方程式为
查看答案和解析>>
科目:高中化学 来源:2016届江苏省南通市高三上学期第一次阶段测化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.无色溶液中:K+、Na+、Cu2+、SO42-
B.c(OH-)=10-13 mol·L-1的溶液中:Al3+、NO3-、I-、Cl-
C.水电离产生的c(H+)=10-13 mol·L-1的溶液中:Na+、Cl-、NO3-、SO42-
D.0.1 mol·L-1FeSO4溶液中:K+、NH4+、MnO4-、ClO-
查看答案和解析>>
科目:高中化学 来源:2016届江苏省苏北四市高三上学期期中质量抽测化学试卷(解析版) 题型:填空题
葡萄酒常用Na2S2O5做抗氧化剂。
(1)1.90g Na2S2O5最多能还原 mLO2(标准状况)。
(2)0.5mol Na2S2O5溶解于水配成1L溶液,该溶液pH=4.5。溶液中部分微粒浓度随溶液酸碱性变化如图所示。

写出Na2S2O5溶解于水的化学方程式 ;当溶液pH小于1后,溶液中H2SO3的浓度变小,其原因可能是 。
已知:Ksp[BaSO4]=1×10-10,Ksp[BaSO3]=5×10-7。把部分被空气氧化的该溶液pH调为10,向溶液中滴加BaCl2使SO42-沉淀完全[c(SO42-)≤1×10-5mol·L-1],此时溶液中c(SO32-)≤ mol·L-1。
(3)葡萄酒样品中抗氧化剂的残留量测定(已知: SO2+I2+2H2O=H2SO4+2HI):准确量取100.00mL葡萄酒样品,加酸蒸馏出抗氧化剂成分。取馏分于锥形瓶中,滴加少量淀粉溶液,用物质的量浓度为0.0225mol·L-1标准I2溶液滴定至终点,消耗标准I2溶液16.02mL。重复以上操作,消耗标准I2溶液15.98mL。计算葡萄酒样品中抗氧化剂的残留量 (单位:mg·L-1,以SO2计算,请给出计算过程。)
查看答案和解析>>
科目:高中化学 来源:2016届江苏省苏北四市高三上学期期中质量抽测化学试卷(解析版) 题型:选择题
我国新修订的《环境保护法》已于2015年1月1日起施行。下列做法不应该提倡的是
A.用CO2合成聚碳酸酯等可降解塑料,减少白色污染
B.推广燃煤发电,停建核电站,避免核泄漏事故的危害
C.加强生活污水的脱氮除磷处理,遏制水体的富营养化
D.实施化石燃料脱硫脱硝技术,减少大气污染物的排放
查看答案和解析>>
科目:高中化学 来源:2015-2016学年云南省高一上学期10月月考化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.标准状况下任何气体的摩尔体积都是22.4 L
B.1 mol气体的体积若是22.4 L,它必定处于标准状况
C.两种气体的物质的量之比等于其原子个数比
D.标准状况下,1 mol H2和O2的混合气体的体积是22.4 L
查看答案和解析>>
科目:高中化学 来源:2016届广东省高三上学期12月月考理综化学试卷(解析版) 题型:选择题
X、Y、Z、W、R是短周期主族元素,X原子最外层电子数是次外层的两倍,Y元素在地壳中的含量最多,Z元素的化合物的焰色反应呈黄色,W 元素的最高价氧化物的水化物可溶于Z元素的最高价氧化物的水化物,R原子的核外电子数是X原子与Z原子的核外电子数之和。下列叙述正确的是
A.原子半径的大小顺序r(X)>r(Y)>r(Z)>r(R)>r(W)
B.氢气在R的单质中燃烧火焰呈蓝色
C.元素X的氢化物的稳定性比Y的弱
D.Y与Z形成的两种化合物中的化学键类型均相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com