
| A. | 溴水 | B. | 氧气 | ||
| C. | 酸性高锰酸钾溶液 | D. | 氢气 |
分析 乙烯含有C=C官能团,能与溴水发生加成反应,能被酸性高锰酸钾溶液氧化,注意除杂时不能引入新的杂质,且不能影响被提纯的物质.
解答 解:A.通入溴水中,乙烯与溴水发生加成反应生成二溴乙烷,溴水褪色,既可以用来鉴别乙烷和乙烯,又可以用来除去乙烷中混有的乙烯,故A正确;
B.在空气中燃烧不能将乙烷中的乙烯除去,故B错误;
C.通入酸性高锰酸钾溶液中,但是生成二氧化碳气体,引入新的杂质,故C错误;
D.在一定条件下通入氢气不能鉴别乙烷和乙烯,且能引入新的杂质,故D错误.
故选A.
点评 本题考查有机物的鉴别和除杂问题,为高频考点,注意乙烷和乙烯的性质的异同,注意乙烯与酸性高锰酸钾反应生成二氧化碳的性质,题中乙烯虽能与氢气在一定条件发生加成反应生成乙烷,但不能鉴别乙烯和乙烷,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 2Al+2OH-+2H2O=2AlO2-+3H2↑ | |
| B. | 2HCO3-+2AlO2-+H2O=2CO2↑+2Al(OH)3↓ | |
| C. | NH4++AlO2-+2H2O=NH3•H2O+Al(OH)3↓ | |
| D. | 3H++Al(OH)3=Al3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲乙装置连接是a接c、b接d | |
| B. | 甲装置工作时H+ 移向负极 | |
| C. | 乙装置阴极室溶液的pH与电解前相比将升高 | |
| D. | a和c电极都发生CO(NH2)2-6e-+H2O═N2↑+CO2↑+6H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发时,只要蒸发皿中出现固体,立即停止加热 | |
| B. | 蒸馏时,温度计水银球应插入液体中,但不能碰到烧瓶内壁 | |
| C. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 焰色反应时,用稀硫酸洗净铂丝,并在火焰上灼烧至无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  装置中阳极上析出红色固体 | B. | 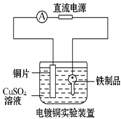 装置中铜片应与电源负极相连 | ||
| C. |  装置中外电路电流方向:b极→a极 | D. |  装中阴极反应:2Cl--2e-═Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 ,反应类型氧化反应;
,反应类型氧化反应; ,反应类型加聚反应.
,反应类型加聚反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com