
 已知:A为单质,常温下C、D为气态.F是三大强酸之一,X为常见金属.图中部分反应物和生成物略去.
已知:A为单质,常温下C、D为气态.F是三大强酸之一,X为常见金属.图中部分反应物和生成物略去. 2SO3;气体D是二氧化硫使溴水褪色生成F的离子方程式为:
2SO3;气体D是二氧化硫使溴水褪色生成F的离子方程式为: 2SO3;SO2+Br2+2H2O=SO42-+4H++2Br-;
2SO3;SO2+Br2+2H2O=SO42-+4H++2Br-;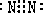 C是NH3,分子结构为三角锥形,故答案为:
C是NH3,分子结构为三角锥形,故答案为: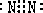 ;三角锥形;
;三角锥形; Mg3N2,故答案为:3Mg+N2
Mg3N2,故答案为:3Mg+N2 Mg3N2;
Mg3N2;

 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
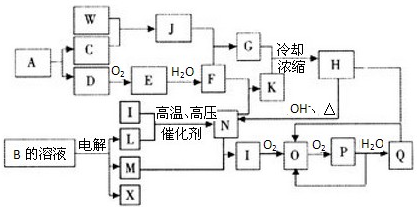
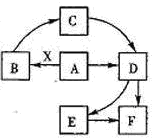 (2009?合肥二模)已知:A为单质,常温下C、D为气态.F是三大强酸之一,X为常见金属.图中部分反应物和生成物略去.
(2009?合肥二模)已知:A为单质,常温下C、D为气态.F是三大强酸之一,X为常见金属.图中部分反应物和生成物略去.
| ||
| △ |
| ||
| △ |
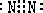
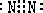
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:合肥二模 题型:问答题
查看答案和解析>>
科目:高中化学 来源:2009年安徽省合肥市高考化学二模试卷(解析版) 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com