
(10分)已知Fe2O3与H2反应会因温度不同而可能生成Fe3O4。兴趣小组在用H2还原Fe2O3的实验中,用磁铁吸出生成的黑色粉末X。为探究X的组成,他们进行了如下实验。
(1)甲同学认为黑色粉末能被磁铁吸附,因此X是铁。但乙同学不同意他的结论,原因是
。
(2)乙同学:先将少量黑色粉末X放入装有足量硫酸铜溶液烧杯中,振荡,固体部分溶解,有极少量红色物质析出,过滤;然后向滤渣加入盐酸,滴加几滴KSCN溶液,溶液出现血红色。通过现象分析,丙同学得出X的组成是Fe和Fe3O4.
①滴加KSCN溶液的目的是:________________________________________
②若在粉末X直接加入盐酸、KSCN溶液,溶液不出现血红色。不出现血红色的原因是(用离子方程式表示)_________________________________________________________。
(3)丁同学的实验方案:
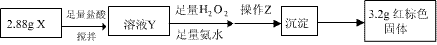
①操作Z是 。
②通过以上数据,得出2.88g黑色粉末X中各成分的物质的量为 ____________________ 。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 Ⅰ.用碳棒作电极,电解下列水溶液:①Na2SO4溶液 ②AgNO3溶液 ③KCl溶液 ④CuCl2溶液.通过相同电量时,阴极产生的气体物质的量相同的是(填序号)
Ⅰ.用碳棒作电极,电解下列水溶液:①Na2SO4溶液 ②AgNO3溶液 ③KCl溶液 ④CuCl2溶液.通过相同电量时,阴极产生的气体物质的量相同的是(填序号)查看答案和解析>>
科目:高中化学 来源:2010-2011学年河南省焦作市高二上学期期末考试化学试卷 题型:填空题
(19分)
Ⅰ.用碳棒作电极,电解下列水溶液:①Na2SO4溶液②AgNO3溶液③KCl溶液④CuCl2溶液。通过相同电量时,阴极产生的气体物质的量相同的是(填序号)_________;通过相同电量时,产生的气体总物质的量由多到少的排列顺序是(填序号)__________。
Ⅱ.到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源。
(1)化学反应中放出的能量(焓变,△H)与反应物和生成物的键能(E)有关。
已知:H2(g)+Cl2(g)=2HCl(g) △H=-185 KJ/mol
E(H-H)=436 KJ/mol, E(Cl-Cl)=247 KJ/mol,则E(H-Cl)=_____
(2)已知Fe2O3(s)+3CO(g)=2Fe(s)+3CO2 (g) △H=-25 KJ/mol
(g) △H=-25 KJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H=-47 KJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+19 KJ/mol
请写出CO还原FeO的热化学方程式:_________________________________。
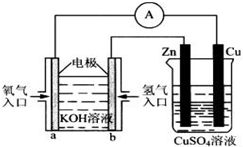
(3)如图所示的装置:
该装置中Cu极为_____极;当铜片的质量变化了12.8g时,a极上消耗的O2在标准状况下的体积为_______L。
查看答案和解析>>
科目:高中化学 来源:同步题 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com