
 科学家研制的离子液体火箭推进剂AF-M315E,其主要成分是羟基硝酸铵,它比肼燃烧释放能量更高、更安全、环保.下列说法不正确的是( )
科学家研制的离子液体火箭推进剂AF-M315E,其主要成分是羟基硝酸铵,它比肼燃烧释放能量更高、更安全、环保.下列说法不正确的是( )| A. | 羟基硝酸铵中阳离子的各原子共平面 | |
| B. | 羟基硝酸铵易溶于水 | |
| C. | 羟基硝酸铵中含有离子键和共价键 | |
| D. | 9.6g羟基硝酸铵中含有0.2mol离子 |
分析 A.羟基硝酸铵中阳离子空键构型为三角锥型;
B.羟基硝酸铵是由硝酸根离子与羟基氨根离子通过离子键构成,硝酸盐易溶于水;
C.羟基硝酸铵中存在硝酸根离子与羟基氨根离子的离子键,硝酸根离子中氮原子与氧原子存在共价键,羟基氨根离子中存在存在O-H、N-H共价键;
D.羟基硝酸铵的式量为96,摩尔质量为96g/mol,一个羟基硝酸铵中含有1个硝酸根离子和一个羟基氨根离子.
解答 解:A.羟基硝酸铵中阳离子空键构型为三角锥型,所以羟基氨根离子中氮原子与氢原子不可能都共面,故A错误;
B.羟基硝酸铵是由硝酸根离子与羟基氨根离子通过离子键构成,硝酸盐易溶于水,故B正确;
C.羟基硝酸铵中存在硝酸根离子与羟基氨根离子的离子键,硝酸根离子中氮原子与氧原子存在共价键,羟基氨根离子中存在存在O-H、N-H共价键,故C正确;
D.一个羟基硝酸铵中含有1个硝酸根离子和一个羟基氨根离子,9.6g羟基硝酸铵的物质的量=$\frac{9.6g}{96g/mol}$=0.1mol,含有离子的物质的量=0.1mol×2=0.2mol,故D正确;
故选:A.
点评 本题考查了物质的组成及结构,明确羟基硝酸铵的结构图是解题关键,注意离子化合物共价化合物的区别,题目难度中等.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:解答题
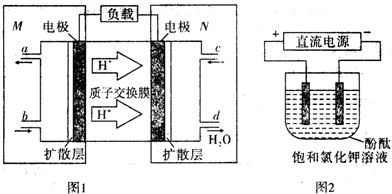
| 起始浓度 | 甲 | 乙 | 丙 |
| c(NO2)/mol•L-1 | 0.10 | 0.20 | 0.20 |
| c(SO2)/mol•L-1 | 0.10 | 0.10 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 80mL10mol/L的浓盐酸与足量的MnO2加热反应,产生Cl2分子数约为0.2NA | |
| B. | 一定条件下,将1molN2和3molH2混合,充分反应后转移电子数为6NA | |
| C. | 钠在空气中燃烧可生成多种氧化物.23g钠充分燃烧时转移电子数为1NA | |
| D. | 常温常压下,等质量的CO和N2中含有原子数目均为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ns电子的能量可能低于(n-1)p电子的能量 | |
| B. | 6C的电子排布式1s22s22px2反了洪特规则 | |
| C. | 电子排布式(21Sc)1s22s22p63s23p63d3违反了能量最低原理 | |
| D. | 电子排布式(22Ti)1s22s22p63s23p10违反了泡利原理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向含有3mol的FeI2溶液中通入标准状况下89.6L 氯气:2Fe2++6I-+4Cl2═2Fe3++3I2+8Cl- | |
| B. | 向铜片中滴加18.4mol/L的浓硫酸并加热:Cu+4H++SO42-$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++SO2↑+2H2O | |
| C. | 向氯化银浊液中加入Na2S溶液:2AgCl+S2-═Ag2S+2Cl- | |
| D. | 向NaAlO2溶液中滴加NaHCO3溶液:AlO2-+HCO3-+H2O═Al(OH)3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 甲中△H1=-(△H2+△H3) | |
| B. | 乙表示恒温恒容条件下发生的可逆反应2NO2(g)═N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 | |
| C. | 丙表示A、B两物质的溶解度随温度变化情况,将tl℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A | |
| D. | 丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH大于等物质的量浓度的NaB溶液的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
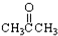 ③CH3CH2Br ④
③CH3CH2Br ④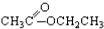 ⑤
⑤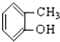 ⑥
⑥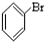 ⑦
⑦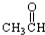 ⑧
⑧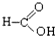 ⑨
⑨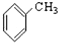 ⑩
⑩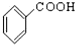
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com