
| A、②③④⑤⑥⑧ | B、①②③④⑤⑥⑦⑧ | C、③④⑤⑥⑧ | D、③④⑤⑥⑦⑨⑩ |
科目:高中化学 来源: 题型:阅读理解
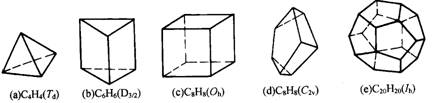
原子簇化学是当前化学中最饶有兴趣而又极其活跃的领域之一。当前比较全面的定义是由徐光宪、江元生等人提出的:凡以3个或3个以上原子直接键合构成的多面体或笼为核心,连接外围原子或基团而形成的结构单元称原子簇.分子式为CnHn的多面体碳烷是典型的主族簇合物,下面是已经报道的碳烷多面体,请归纳总键数为 ;若多面体边数为l,则总键数用n和l表示为多少
 2.端木守拙科研课题是“碱金属卤化物的分子动力学模拟”,研究了体积较大的碱金属卤化物离子簇。从NaCl晶体中可以抽取出不同形状的晶体小碎片,这些晶体小碎片可以称为NaCl离子团簇。离子晶体或离子团簇表面存在悬挂键(即表面的离子有一种没有抓住相邻原子的化学键)。
2.端木守拙科研课题是“碱金属卤化物的分子动力学模拟”,研究了体积较大的碱金属卤化物离子簇。从NaCl晶体中可以抽取出不同形状的晶体小碎片,这些晶体小碎片可以称为NaCl离子团簇。离子晶体或离子团簇表面存在悬挂键(即表面的离子有一种没有抓住相邻原子的化学键)。
右图是立方体形状的NaCl离子团簇,其中大球代表Cl-,小球表代Na+。请回答下列问题:
①与等质量的NaCl离子晶体相比,NaCl离子团簇具有_______(填“较多”或“较少”)的悬挂键;
②NaCl离子团簇的熔点比NaCl大块晶体的熔点要______(填“高”、“低”或“―样”);
③如果团簇中离子对数相同,则团簇的总能量与团簇的外形是否有关 。
④(NaCl)864立方体离子簇的边长相当于 个NaCl单胞的边长。
⑤但是体积小的团簇有特殊性。Na5Cl4+无法形成面心立方结构,它的几种结构中,最稳定的是具有高对称性的平面结构,请画出其结构式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com