
同温同压下,等质量的CO和CO2相比较,下列叙述中正确的是( )
A.密度比为11 :7 B.分子数比为7∶11
C.原子数比为22 ∶21 D.体积比为7∶11
科目:高中化学 来源:2016-2017学年黑龙江佳木斯一中高一上月考二化学卷(解析版) 题型:选择题
用可溶性钡盐检验SO42-离子的存在时,先在待测溶液中加入盐酸,其作用是
A.形成较多的白色沉淀
B.排除SO42- 以外的其它阴离子及Ag+的干扰
C.形成的沉淀纯度更高
D.排除Ba2+ 以外的其它阳离子的干扰
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上学期第二次月考化学试卷(解析版) 题型:选择题
已知A、B、C、D之间的转化关系如图所示。下列说法正确的是
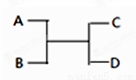
A.若A为Fe,D为氢气,则B一定为酸
B.若A、D为化合物,B为水,则C一定是气体单质
C.若A、B、C、D均为化合物,该反应一定属于复分解反应
D.若A、B、C、D均为10电子微粒,且C是可使湿润的红色石蕊试纸变蓝的气体,则D常温下一定呈液态
查看答案和解析>>
科目:高中化学 来源:2016-2017陕西西安长安区一中重点班高一12月考化学卷(解析版) 题型:推断题
有三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属。三种金属单质A、B、C能与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有全部标出)。
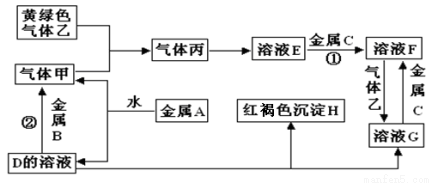
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:
A__________________;H _______________;乙______________;
(2)写出下列反应的化学方程式
反应①_________________________________
反应②_________________________________
(3)检验溶液E中阴离子的实验方法是滴加硝酸酸化的__________(填化学式)溶液,出现白色沉淀;滴加硫氰化钾溶液可检验溶液G中阳离子,现象是溶液颜色变为________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017陕西西安长安区一中重点班高一12月考化学卷(解析版) 题型:选择题
下列离子方程式正确的是 ( )
A.将氯气通入氯化亚铁溶液:2Fe2++Cl2=2Fe3++2Cl-
B.钠与水的反应:Na+2H2O=Na++
 2OH-+H2↑
2OH-+H2↑
C.氢氧化钡溶液与稀硫酸混合:Ba2++SO42- =BaSO4↓
D.金属铝溶于氢氧化钠溶液:Al+2OH-=AlO2-+H2↑
查看答案和解析>>
科目:高中化学 来源:2016-2017陕西西安长安区一中重点班高一12月考化学卷(解析版) 题型:选择题
为了验证小苏打中是否含有纯碱,下列实验操作及判断正确的是 ( )
A.观察加热时是否放出气体
B.观察滴加盐酸时能否放出气体
C.溶于水中,滴加澄清石灰水,观察有无白色沉淀产生
D.溶于水中,滴加少量的氯化钡溶液,观察有无白色沉淀产生
查看答案和解析>>
科目:高中化学 来源:2016-2017陕西西安长安区一中实验班高一12月考化学卷(解析版) 题型:填空题
明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,还含有少量Fe2O3杂质。利用明矾石制备氢氧化铝的流程如下:

(1)焙烧炉中发生反应的化学方程式为2Al2(SO4)3+3S 2Al2O3+9SO2,该反应的氧化剂是___________;若生成1 mol Al2O3,则转移的电子数为__________________。
2Al2O3+9SO2,该反应的氧化剂是___________;若生成1 mol Al2O3,则转移的电子数为__________________。
(2)熟料溶解时,反应的离子方程式为________________。
(3)母液中溶质主要成分为__________。(填化学式)
(4)检验废渣中主要成分的方法:
①操作__________________________,
②现象__________________________,
③结论__________________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017陕西西安长安区一中实验班高一12月考化学卷(解析版) 题型:选择题
某同学在实验室进行了如图所示的实验,下列说法中错误的是( )

A.利用过滤的方法,可将Z中固体与液体分离
B. X、Z 烧杯中分散质相同
C. Y 中反应的离子方程式可能为: 3CaCO3+2Fe3++3H2O=2Fe(OH)3+3CO2↑+3Ca2+
D. Z 中分散系能产生丁达尔效应
查看答案和解析>>
科目:高中化学 来源:2017届安徽马鞍山二中安师大附中高三12月联考化学卷(解析版) 题型:选择题
甲、乙两组同学利用如下两反应(K为25℃时的平衡常数)设计成原电池(装置如图)。
① AsO43—+2I-+2H+ AsO33-+I2+H2O K1=14.2
AsO33-+I2+H2O K1=14.2
② 2Fe3++2I- 2Fe2++I2 K2=1.1×108
2Fe2++I2 K2=1.1×108
左池溶液都相同(KI-I2溶液),右池溶液不同:甲组为Na3AsO4和Na3AsO3的混合溶液,乙组为FeCl3和FeCl2的混合溶液。
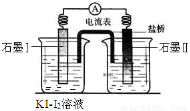
当电流表指针指向零点后再改变右池的条件,改变的条件及电流表指针偏转情况记录如下:
操作 | 电流表指针偏转情况 | |
甲组 | 若滴加浓盐酸 | 偏向左方 |
若滴加浓NaOH溶液 | 偏向右方 | |
乙组 | 若滴加浓FeCl2溶液 | 不偏转 |
若滴加浓FeCl3溶液 | 偏向左方 |
则下列叙述错误的是( )
A.同温同浓度时,氧化性:Fe3+>AsO43—
B.与反应②比较,反应①平衡常数小,可逆程度大
C.左池中滴加淀粉溶液变蓝色,再加入足量FeCl2固体,蓝色会褪去
D.甲组在右池加入浓NaOH溶液,此时石墨Ⅱ为负极,AsO33—被氧化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com