
| A. | 等于7.1g | B. | 小于7.1g | ||
| C. | 大于7.1g,小于14.2g | D. | 大于14.2g |
分析 发生反应:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,随反应进行浓盐酸变稀,稀盐酸不二氧化锰反应,故14.6HCl不能完全反应.
解答 解:假设HCl完全反应,生成氯气质量为m,则:
MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
146 71
14.6g m
所以m=$\frac{14.6g×71}{146}$=7.1g
随反应进行浓盐酸变稀,稀盐酸不二氧化锰反应,故14.6HCl不能完全反应,则可制得Cl2的质量小于7.1g.
故选:B.
点评 本题考查学生利用化学反应方程式的计算,关键是明确稀盐酸不二氧化锰反应,注意对元素化合物性质的掌握,题目难度不大.


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 微粒组 | 加人试剂 | 发生反应的离子方程式 |
| A | Na+、Fe3+、I-、Cl- | NaOH溶液 | Fe3++3OH-═Fe(OH)3↓ |
| B | K+、NH3•H2O、CO32- | 通入少量CO2 | 2OH-+CO2═CO32-+H2O |
| C | H+,Fe2+、SO42-、Cl- | Ba(NO3)2溶液 | SO42-+Ba2+═BaSO4↓ |
| D | Na+、Al3+、Cl-、NO3- | 少量澄淸石灰水 | Al3++3OH-═Al(OH)3↓ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | a | b | c | d |
| A | Pt | Pt | NaOH | NaOH |
| B | C | C | NaCl | NaOH |
| C | Cu | Cu | CuSO4 | Cu(OH)2 |
| D | Pt | Pt | H2SO4 | H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+、K+、Cl-、NO3- | B. | Na+、Ca2+、SO32-、ClO- | ||
| C. | Al3+、K+、OH-、NO3- | D. | Na+、Ca2+、SiO32-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
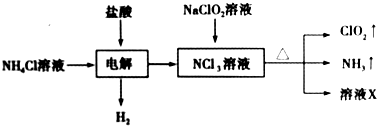
| A. | 电解时发生反应的离子方程式为NH4++3Cl-$\frac{\underline{\;电解\;}}{\;}$2H2↑+NCl3 | |
| B. | 溶液X中大量存在的阴离子有Cl-、OH- | |
| C. | 可用饱和食盐水除去ClO2中的NH3 | |
| D. | 可用明矾除去饮用水中残留的NaClO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
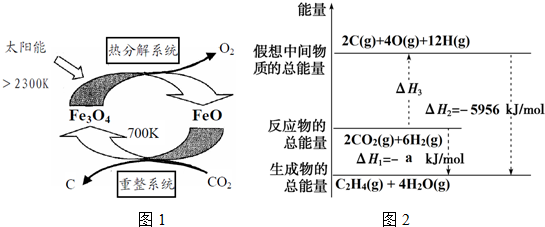
| 物质 | CO2(g) | C2H4(g) | H2O(g) |
| 能量/kJ•mol-1 | -394 | 52 | -242 |
| 化学键 | C=O | H-H | C=C | O-H |
| 键能/kJ•mol-1 | 803 | b | 615 | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
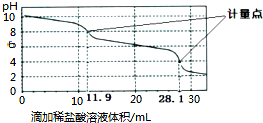
| A. | 上一计量点前发生反应的离子方程式为HCO3-+H+═H2O+CO2↑ | |
| B. | 下一个计量点溶液中存在大量的阴离子是Cl-、HCO3- | |
| C. | 此样品n(NaHCO3)=(28.1-2×11.9)×10-3mol | |
| D. | 使用该方法测定Na2CO3和NaOH混合物中氢氧化钠含量,将会得到1个计量点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
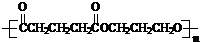 )是一种可降解的聚酯类高分子材料,在材料的生物相容性方面有很好的应用前景.PPG的一种合成路线如下:
)是一种可降解的聚酯类高分子材料,在材料的生物相容性方面有很好的应用前景.PPG的一种合成路线如下: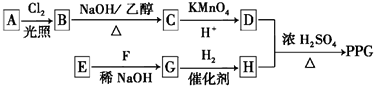
 .
.
 .
. .
. .
.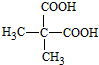 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com