
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
分析 (1)H2S与Na2CO3溶液反应生成两种酸式盐为硫氢化钠和碳酸氢钠;
(2)利用盖斯定律计算①2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.3kJ•mol-1
由盖斯定律可知,通过①×2+②+③可得所求反应方程式,
改变条件增大反应速率,可以采取加入催化剂、升温、加压、增大浓度等措施,且提高CO的转化率应使平衡向正反应方向移动,结合平衡移动原理分析解答;
(3)①平衡常数等于生成物平衡浓度幂之积与反应物平衡浓度幂之积的比,结合平衡浓度计算,依据浓度商和平衡常数比较判断反应进行的方向;
②根据平衡常数列式计算平衡浓度,c=$\frac{n}{V}$;
解答 解:(1)H2S与Na2CO3溶液反应生成两种酸式盐为硫氢化钠和碳酸氢钠,反应方程式为Na2CO3+H2S═NaHCO3+NaHS,
故答案为:Na2CO3+H2S═NaHCO3+NaHS;
(2)①2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.3kJ•mol-1
由盖斯定律可知,通过①×2+②+③可得所求反应方程式,则△H=-90.8kJ•mol-1×2-23.5kJ•mol-1-41.3kJ•mol-1=-246.4kJ•mol-1;
a.正反应为气体体积减小的反应,减压,平衡向逆反应方向移动,CO的转化率减小,故a错误;
b.加入催化剂,反应速率增大,不影响平衡移动,CO的转化率不变,故b错误;
c.减少CO2的浓度,平衡向正反应方向移动,CO的转化率增大,故c正确;
d.增加CO的浓度,反应速率增大,平衡向正反应移动,但CO的转化率减小,故d错误;
e.分离出二甲醚,平衡向正反应移动,CO的转化率增大,故e正确;故选ce.
故答案为:-246.4kJ•mol-1;ce;
(3)①该反应的平衡常数表达式为:K=$\frac{[C{H}_{3}OC{H}_{3}[{H}_{2}O]]}{[C{H}_{3}OH]^{2}}$,将所给浓度带入平衡常数表达式:$\frac{0.6×0.6}{0.4{4}^{2}}$=1.86<400,故反应向正反应方向进行,正反应速率大于逆反应速率,
故答案为:>;
②依据化学平衡三行计算列式,设10min达到平衡生成甲醚物质的量为x,
2CH3OH(g)≒CH3OCH3(g)+H2O(g)
某时刻浓度(mol•L-1):0.44 0.6 0.6
转化浓度(mol•L-1):2x x x
平衡浓度(mol•L-1):0.44-2x 0.6+x 0.6+x
K=$\frac{(0.6+x)^{2}}{(0.6-x)^{2}}$=400,解得x=0.2mol/L,
故平衡时c(CH3OH)=0.44mol/L-0.2mol/L×2=0.04mol/L,
故答案为:0.04 mol•L-1;
点评 本题考查反应热计算、化学平衡影响因素、化学平衡计算等,难度中等,注意盖斯定律及平衡三行计算的应用.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 含有0.1mol•L-1CO32-的溶液:Na+、Al3+、NO3-、S2- | |
| B. | 无色溶液:K+、H+、SCN-、SO42- | |
| C. | $\frac{Kw}{c{(H}^{+})}$=0.1mol/L的溶液:Na+、K+、HCO3-、NO3- | |
| D. | 在由水电离出的c(H)=1.0×10-13mol•L-1的溶液中:Na+、Fe3+、Cl-、CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓 度/mol•L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
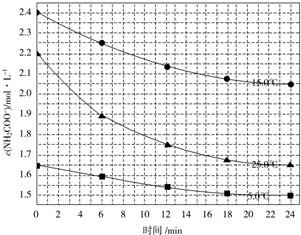
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
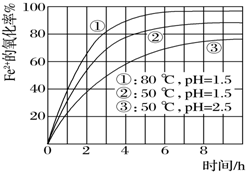 为了研究一定浓度Fe2+的溶液在不同条件下被氧气氧化的氧化率,实验结果如图所示,判断下列说法错误的是( )
为了研究一定浓度Fe2+的溶液在不同条件下被氧气氧化的氧化率,实验结果如图所示,判断下列说法错误的是( )| A. | pH越小氧化率越小 | |
| B. | 温度越高氧化率越大 | |
| C. | Fe2+的氧化率除受pH、温度影响外,还受其它因素影响,如浓度等 | |
| D. | 实验说明降低pH、升高温度有利于提高Fe2+的氧化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸见光分解:4HNO3$\frac{\underline{\;光照\;}}{\;}$4NO2↑+O2↑+2H2O | |
| B. | 往NaOH溶液中通入过量二氧化硫:2NaOH+SO2═Na2SO3+H2O | |
| C. | SO2气体通入BaCl2溶液中产生白色沉淀:SO2+BaCl2+H2O═BaSO3↓+2HCl | |
| D. | Fe与稀H2SO4反应的化学方程式为:2Fe+3H2SO4═Fe2(SO4)3+3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 温度℃ | 25 | 80 | 230 |
| 平衡常数 | 5×104 | 2 | 1.9×10-5 |
| A. | 上述反应是熵增反应 | |
| B. | 在80℃时,测得某时刻Ni(CO)4、CO浓度均为0.5 mol•L-1,则此时反应逆向进行 | |
| C. | 25℃时,反应Ni(CO)4(g)?Ni(s)+4CO(g)的平衡常数是0.5 | |
| D. | 恒温恒容,向已达平衡的容器中再充入少量Ni(CO)4(g),达到新平衡时,CO的体积百分含量将减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 炼铁时增大高炉的高度,能有效减少CO的排放 | |
| B. | 明矾在水处理中可作净水剂 | |
| C. | 热电厂进行燃煤时将煤块压碎以提高煤的燃烧效率 | |
| D. | 在海轮外壳上镶嵌锌块,能减缓船体的腐蚀速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com