
| A. | ①②③ | B. | ①②④ | C. | ③④⑤ | D. | ①③⑤ |
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:实验题
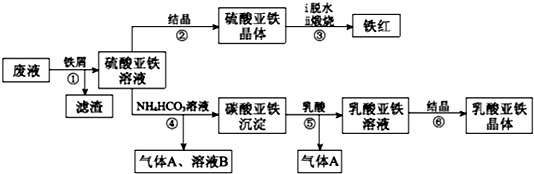
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12C与14C | B. | CH3CH2OH与CH3COOH | ||
| C. | 甲烷与丙烷 | D. | CH3CH2CH2CH3与CH3CH(CH3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量数是60 | B. | 质子数是60 | C. | 中子数是33 | D. | 电子数是27 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标况下,22.4LSO3含有σ键数目为3NA | |
| B. | 已知:N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1,则某容器内加入0.5 NA个N2(g)与足量的H2(g),充分反应后放出的热量为46 kJ | |
| C. | 标准状况下,22.4L氦气含有的原子数为2NA | |
| D. | 0.1mol HCN分子中含有的π键数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 .它是由乙烯和对二甲苯经过一系列反应后的产物缩聚而成的,则合成过程中乙烯与对二甲苯的物质的量之比为( )
.它是由乙烯和对二甲苯经过一系列反应后的产物缩聚而成的,则合成过程中乙烯与对二甲苯的物质的量之比为( )| A. | 1:1 | B. | 2:1 | C. | 1:2 | D. | 3:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com