
A、H2O2的电子式为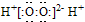 | ||||||
B、O2-、Na的结构示意图都可以用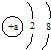 表示 表示 | ||||||
| C、H2O、NaOH、Na2O2中氧元素的化合价均为-2 | ||||||
D、
|


科目:高中化学 来源: 题型:
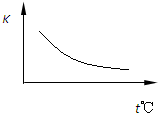 工业上制备H2的一种重要方法是:CO(g)+H2O(g)?CO2(g)+H2(g)△H=Q kJ?mol-1.已知该反应的平衡常数K与温度的关系如图所示.若在一固定的密闭容器中,850℃时发生上述反应,并测得容器内各物质的浓度(mol?L-1)随时间的变化关系如下表:
工业上制备H2的一种重要方法是:CO(g)+H2O(g)?CO2(g)+H2(g)△H=Q kJ?mol-1.已知该反应的平衡常数K与温度的关系如图所示.若在一固定的密闭容器中,850℃时发生上述反应,并测得容器内各物质的浓度(mol?L-1)随时间的变化关系如下表:| Kt℃ 时间/min |
CO(g) | H2O(g) | CO2(g) | H2(g) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c4 |
| 4 | c1 | c2 | c3 | c4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(15分)以铬铁矿[主要成份为Fe(CrO2)2,含有Al2O3、Fe2O3、SiO2等杂质]为主要原料生产重铬酸钠晶体(Na2Cr2O7·2H2O)的主要工艺流程如下:


(1)煅烧过程中,铬铁矿中的Al2O3与纯碱反应的化学方程式为 ▲ 。
(2)酸化时发生的反应为:2CrO42-+2H+![]() Cr2O72-+H2O,若1L酸化后所得溶液中含铬元素的质量为28.6 g,CrO42-有
Cr2O72-+H2O,若1L酸化后所得溶液中含铬元素的质量为28.6 g,CrO42-有![]() 转化为Cr2O72-。
转化为Cr2O72-。
①酸化后所得溶液中c(Cr2O72-)= ▲ ;
②已知:常温时该反应的平衡常数K=1014。上述酸化后所得溶液的pH=
▲ 。
(3)根据有关国家标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7 mol·L-1以下才能排放。含CrO42-的废水处理通常有以下两种方法。
①沉淀法:加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入可溶性硫酸盐处理多余的Ba2+。加入可溶性钡盐后的废水中Ba2+的浓度应不小于 ▲ mol·L-1,后续废水处理方能达到国家排放标准。
②还原法:CrO42-![]() Cr3+
Cr3+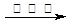 Cr(OH)3。用该方法处理10 m3 CrO42-的物质的量浓度为1.5×10—3mol·L-1的废水,至少需要绿矾(FeSO4·7H2O) ▲ kg。
Cr(OH)3。用该方法处理10 m3 CrO42-的物质的量浓度为1.5×10—3mol·L-1的废水,至少需要绿矾(FeSO4·7H2O) ▲ kg。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省高三上学期练习化学试卷 题型:实验题
(15分)以铬铁矿[主要成份为Fe(CrO2)2,含有Al2O3、Fe2O3、SiO2等杂质]为主要原料生产重铬酸钠晶体(Na2Cr2O7·2H2O)的主要工艺流程如下:


(1)煅烧过程中,铬铁矿中的Al2O3与纯碱反应的化学方程式为 ▲ 。
(2)酸化时发生的反应为:2CrO42-+2H+ Cr2O72-+H2O,若1L酸化后所得溶液中含铬元素的质量为28.6 g,CrO42-有
Cr2O72-+H2O,若1L酸化后所得溶液中含铬元素的质量为28.6 g,CrO42-有 转化为Cr2O72-。
转化为Cr2O72-。
①酸化后所得溶液中c(Cr2O72-)= ▲ ;
②已知:常温时该反应的平衡常数K=1014。上述酸化后所得溶液的pH=
▲ 。
(3)根据有关国家标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7 mol·L-1以下才能排放。含CrO42-的废水处理通常有以下两种方法。
①沉淀法:加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入可溶性硫酸盐处理多余的Ba2+。加入可溶性钡盐后的废水中Ba2+的浓度应不小于 ▲ mol·L-1,后续废水处理方能达到国家排放标准。
②还原法:CrO42-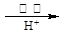 Cr3+
Cr3+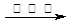 Cr(OH)3。用该方法处理10 m3 CrO42-的物质的量浓度为1.5×10—3
mol·L-1的废水,至少需要绿矾(FeSO4·7H2O) ▲ kg。
Cr(OH)3。用该方法处理10 m3 CrO42-的物质的量浓度为1.5×10—3
mol·L-1的废水,至少需要绿矾(FeSO4·7H2O) ▲ kg。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com