
| A. | 同时改变两个变量来研究反应速率的变化,能更快得出有关规律 | |
| B. | 对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同 | |
| C. | 在滴有酚酞溶液的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7 | |
| D. | 某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐 |
分析 A、同时改变两个变量来研究反应速率的变化,不容易判断影响反应速率的主导因素;
B、这是盖斯定律的表述;
C、酚酞在溶液pH小于8时为无色;
D、常温下,显酸性的物质有酸、强酸的酸式盐、强酸弱碱盐,据此分析.
解答 解:A.同时改变两个变量来研究反应速率的变化,不容易判断影响反应速率的主导因素,因此更难得出有关规律,应改变一个变量,故A错误;
B.根据盖斯定律可知,对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同,故B正确;
C.酚酞在溶液pH小于8时为无色,在滴有酚酞溶液的氨水里,加入NH4Cl溶液恰好无色,则此时溶液的pH<8,pH可能大于7,故C错误;
D.常温下,显酸性的物质有酸,如硫酸;强酸的酸式盐,如硫酸氢钠;强酸弱碱盐,如氯化铵;所以25℃时,某物质的溶液pH<7,则该物质一定是酸、强酸的酸式盐、强酸弱碱盐,故D错误;
故选B.
点评 本题侧重考查反应速率、盖斯定律、等基本概念、规律,侧重于学生的分析和计算能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 物质 | 方法 | 试剂 | |
| A | CO2(SO2) | 洗气 | 氢氧化钠溶液 |
| B | 氯化亚铁溶液(氯化铁) | 过滤 | 铁粉 |
| C | 水(溴) | 萃取、分液 | 酒精 |
| D | 硫酸钠(氯化铵) | 加热 | 氢氧化钠 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-、Na+、NO3-、Ca2+ | B. | MnO4-、HCO3-、Cl-、K+ | ||
| C. | K+、Ba2+、Cl-、SO42- | D. | K+、Mg2+、NO3-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三者的单质在常温下都不溶于浓硫酸和浓硝酸,是因发生了钝化现象 | |
| B. | 三者的单质放置在空气中均只生成氧化物 | |
| C. | 三者所对应的氢氧化物在水中不都存在溶解平衡 | |
| D. | 工业上制备这三种金属的方法依次为电解法、热还原法和热还原法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用活性炭除去冰箱中的异味是发生了化学反应 | |
| B. | 碘是人体必需微量元素,所以要多吃富含碘化钾的食物 | |
| C. | 可以利用氯化铁溶液的酸性清除铜镜表面的铜锈 | |
| D. | 航天服主要成分是由碳化硅、陶瓷和碳纤维复合而成,它是一种新型无机非金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0×l0-5 mo1•L-1盐酸的pH=5,将其稀释1000倍后pH=8 | |
| B. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 | |
| C. | 次氯酸钠溶液中离子浓度:c(Na+)=2c(ClO-)+c(HClO) | |
| D. | 由0.1 mo1•L-1一元酸HA溶液的pH=3,则其Ka=10-2 mo1•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气在氯气中燃烧,产生大量白烟 | |
| B. | 钠在空气中燃烧,最终得到白色固体 | |
| C. | 向硅酸钠溶液中滴加稀盐酸,产生白色胶状物 | |
| D. | 向氯化铝溶液中滴加氨水,先产生白色沉淀,后沉淀消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2CO3?2H++CO32- | B. | HClO═H++ClO- | ||
| C. | NaHCO3=Na++H++CO32- | D. | Ba(OH)2═Ba2++2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
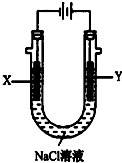 甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455kJ/mol,甲醚可作燃料电池的燃料.
甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455kJ/mol,甲醚可作燃料电池的燃料.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com