
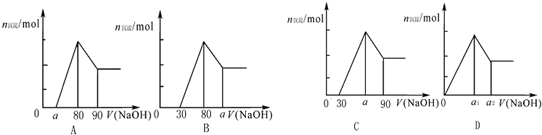
| A、a的取值范围为0≤a<50 | ||
B、
| ||
| C、若将关系图改为B图时,则a的取值范围为80<a<90 | ||
| D、若将关系图改为C图时,则a的取值范围为75<a<90 |
| 50 |
| 3 |
| 90-30 |
| 4 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 (2011?抚顺二模)把一块镁铝合金投入到1mol?L-1 盐酸中,待合金完全溶解后,再往溶液里加入1mol?L-1 NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图所示.下列说法中错误的是( )
(2011?抚顺二模)把一块镁铝合金投入到1mol?L-1 盐酸中,待合金完全溶解后,再往溶液里加入1mol?L-1 NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图所示.下列说法中错误的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
 把一块镁铝合金投入到1mol/L HCl溶液里,待合金完全溶解后,再往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图所示.下列说法中错误的是( )
把一块镁铝合金投入到1mol/L HCl溶液里,待合金完全溶解后,再往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图所示.下列说法中错误的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
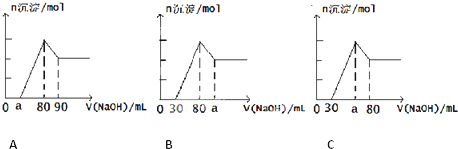
| A、A图中a的取值范围为0≤a<50 | ||
B、A图中
| ||
| C、若将关系图改为B图时,则a的取值范围为80<a<90 | ||
| D、若将关系图改为C图时,则a的取值范围为67.5<a<80 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com