
【题目】下列关于化学反应与能量的说法正确的是( )
A. 由H2→2H的过程需要吸收能量
B. 化学反应中一定有物质变化但不一定有能量变化
C. Ba(OH)2·8H2O晶体与氯化铵晶体反应不需要加热就能发生,说明该反应是放热反应
D. 由石墨制取金刚石需要吸收能量,说明金刚石比石墨更稳定
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】实验室制取少量N2常利用的反应是NaNO2+NH4Cl![]() NaCl+N2↑+2H2O,关于该反应的说法正确的是
NaCl+N2↑+2H2O,关于该反应的说法正确的是
A. NaNO2发生氧化反应
B. 生成1 mol N2时转移的电子数为6 mol
C. NH4Cl中的氮元素被还原
D. 被氧化和被还原的元素是同一种元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废水中含有的NH4+在一定条件下可被O2氧化,反应过程如下:
①NH4+(aq)+3/2O2(g)=NO2-(aq)+2H+(aq)+H2O(l) △H =-273kL/mol
②NO2-(aq)+l/2O2(g)=NO3-(aq) △H =-73kL/mol
下列叙述不正确的是
A. lmol的NH3和1mol的NH4+都有10×6.02×1023个电子
B. 室温下,0.1mol/LHNO2(aq) pH>l,则NaNO2溶液显碱性
C. NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l) △H =-346kL/mol
D. 在上述两次转化过程中,废水的酸性先增大然后逐渐减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2可用作制氧剂、漂白剂。
(1)已知:2CrO42ˉ+2H+![]() Cr2O72ˉ+H2O。在碱性溶液中,Na2O2可以把Cr2(SO4)3中的Cr元素氧化成+6价,该反应的离子方程式为___________________________________。
Cr2O72ˉ+H2O。在碱性溶液中,Na2O2可以把Cr2(SO4)3中的Cr元素氧化成+6价,该反应的离子方程式为___________________________________。
(2)某化学兴趣小组同学欲在实验室中制备少量Na2O2。
查阅资料得知,将钠加热至熔化,通入一定量的除去CO2的空气,维持温度在453—473K之间,钠即被氧化为Na2O;进而增加空气流量并迅速提高温度至573—673K,即可制得Na2O2。

①若采用上述仪器装置制备Na2O2,从左到右仪器的连接顺序为(填接口字母,各装置只能用一次)________;装置D的作用为________。
②装置A中生成Na2O2的化学反应方程式为_______________________。
③若实验时准确称取2.3 gNa进行反应,将反应后的固体溶于1L水中,向所得溶液中加入50 mL 0.5 mol/L NH4Al(SO4)2溶液充分反应,请写出加入NH4A1(SO4)2溶液后发生反应的离子方程式________。
(3)小组同学继续对反应后固体的组成进行探究。
a.取一定量反应后固体,加入足量水充分反应,有气体生成;
b.将生成的气体全部转入真空密闭容器中,放电后充分反应,气体体积减少了3 / 5(不考虑O3的生成)。
①反应后固体中一定有的物质为________(填化学式)。
②为进一步确定反应后固体的组成,需对b中剩余气体继续进行猜想与设计,请完成下表。
猜想 | 实验设计 | 现象与结论 |
剩余气体为___________。 | _______________________________。 | 若看到____________ 证明此猜想正确,反之则不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫单质及其化合物在化工生产、污水处理等领域应用广泛。
(1)煤制得的化工原料气中含有羰基硫(O=C=S),该物质可转化为H2S,主要反应如下:
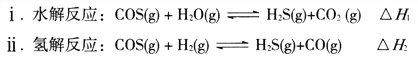
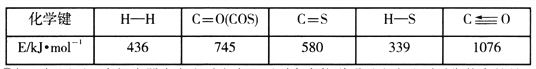
已知反应中相关的化学键键能数据如下表:
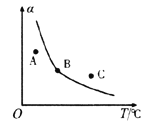
①一定条件下,密闭容器中发生反应i,其中COS(g)的平衡转化率(![]() )与温度(T)的关系如图所示。则A、B、C三点对应的状态中,v(COS)=v(H2S)的是____________。(填标号)
)与温度(T)的关系如图所示。则A、B、C三点对应的状态中,v(COS)=v(H2S)的是____________。(填标号)
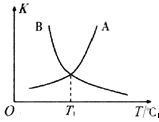
②反应ii的正、逆反应的平衡常数(K)与温度(T)的关系如图所示,其中表示逆反应的平衡常数(K逆)的是__________(填“A”或“B”)。T1℃时,向容积为10 L的恒容密闭容器中充入2 mol COS(g)和1 mol H2(g),发生反应ii,COS的平衡转化率为_____________。
(2)过二硫酸是一种强氧化性酸,其结构式为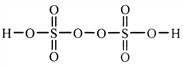
①在Ag+催化作用下,S2O82-能与Mn2+在水溶液中发生反应生成SO42-和MnO4-,该反应的离子方程式为________________________。
②工业上可用惰性电极电解硫酸和硫酸铵混合溶液的方法制备过二硫酸铵。总反应的离子方程式为________________________________。
(3)NaHS可用于污水处理的沉淀剂。已知:25℃时,反应Hg2+(aq)+HS-(aq) ![]() HgS(s)+H+(aq)的平衡常数K=1.75×1038,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15。
HgS(s)+H+(aq)的平衡常数K=1.75×1038,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15。
①NaHS的电子式为____________________。②Ksp(HgS)=_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于离子键和离子化合物的说法正确的是( )
A. 阴、阳离子间通过静电引力形成离子键
B. 阴、阳离子间通过离子键一定能形成离子化合物
C. 离子化合物都能导电,它们都是电解质
D. 只有活泼金属元素和活泼非金属元素化合时,才能形成离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)硅和氯两元素的单质反应生成1 mol Si的最高价化合物,恢复至室温,放热687 kJ,已知该化合物的熔、沸点分别为-69 ℃和58 ℃,写出该反应的热化学方程式__________________________________________。
(2)比较下列溶液中指定微粒浓度的大小:浓度均为0.1 mol·L-1的①H2S、②NaHS、③Na2S、④H2S和NaHS混合液,溶液pH从大到小的顺序是_____________。(填序号)c(H2S)从大到小的顺序是__________。(填序号)
(3)已知Ksp[Cu(OH)2] = 1×10-20 。要使0.2 mol / L 的CuSO4溶液中Cu2+沉淀较为完全,则应向溶液里加入NaOH溶液,调整溶液的pH范围为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com