
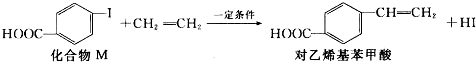
| A. | 对乙烯基苯甲酸的分子式为C9H10O2 | |
| B. | 对乙烯基苯甲酸的同分异构体共有三种 | |
| C. | 对乙烯基苯甲酸既属于羧酸,又属于烯烃 | |
| D. | 二者均可发生取代反应和加成反应 |
分析 A.根据结构简式确定元素种类和原子个数,可确定分子式;
B.对乙烯基苯甲酸中羧基和乙烯基可为邻、间、对位置,且苯环的取代基可为乙烯基、醛基和羟基;
C.含有O元素,不属于烃;
D.化合物M含有羧基和I,可发生缩聚反应,乙烯基苯甲酸含有碳碳双键,可发生加聚反应.
解答 解:A.由结构简式可知分子式为C9H8O2,故A错误;
B.对乙烯基苯甲酸中羧基和乙烯基可为邻、间、对位置,且苯环的取代基可为乙烯基、醛基和羟基,则同分异构体大于三种,故B错误;
C.含有O元素,不属于烃,故C错误;
D.化合物M含有羧基和I,可发生缩聚反应,乙烯基苯甲酸含有碳碳双键,可发生加聚反应,且都可发生取代反应,故D正确.
故选D.
点评 本题考查有机物的结构与性质,为高频考点,注意把握官能团与性质的关系,熟悉烯烃、酸的性质即可解答,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
| 共价键 | C-C | C-N | C-S |
| 键能/kJ•mol-1 | 347 | 305 | 259 |
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
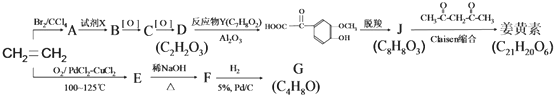
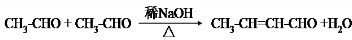 ,F 到 G 的反应类型加成反应或还原反应
,F 到 G 的反应类型加成反应或还原反应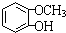 ,姜黄素的结构简式
,姜黄素的结构简式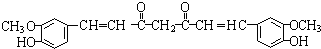
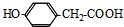 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题

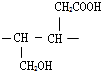 ;
;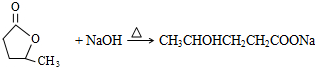 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 海水淡化可以解决淡水供应危机,向海水中加入明矾可以使海水淡化 | |
| B. | 锅炉水垢中的硫酸钙可用碳酸钠溶液处理,使之转化为碳酸钙,再用酸除去 | |
| C. | 日本福岛核电站爆炸时释放的两种放射性核素131I与137Cs(铯)的中子数相等 | |
| D. | 铝合金的大量使用归功于人们能使用焦炭等还原剂从氧化铝中获得铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
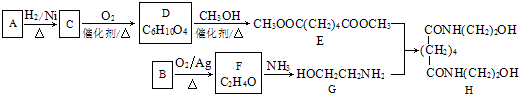
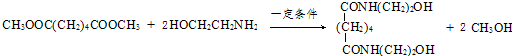 .
.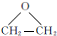 ,能发生银镜反应的F的同分异构体是CH3CHO.
,能发生银镜反应的F的同分异构体是CH3CHO.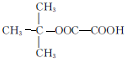 (写结构简式).
(写结构简式).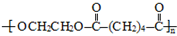 的合成路线.
的合成路线.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 物质 | 杂质 | 除杂质应选用的试剂或操作方法 |
| A | C2H5Br | C2H5OH | 用水洗涤、分液 |
| B | FeCl3 | CaCO3 | 溶解、过滤、蒸发结晶 |
| C | Al2(SO4)3溶液 | MgSO4 | 加入过量烧碱后过滤,再用硫酸酸化滤液 |
| D | CO2 | SO2 | 通过盛有品红溶液的洗气瓶,再通过盛有浓硫酸的洗气瓶 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过滤操作中,漏斗的尖端应接触烧杯内壁 | |
| B. | 从滴瓶中取用试剂时,滴管的尖嘴可以接触试管内壁 | |
| C. | 滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁 | |
| D. | 向容量瓶转移液体时,导流用玻璃棒可以接触容量瓶内壁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com