
某无色透明溶液能与铝粉反应放出H2,则此溶液中可能存在
A.OH-、Ba2+、Cl-、Na+ B.H+、Cl-、Na+、SO42-
C.H+、Cu2+、[Al(OH)4]-、SO42- D.H+、Ba2+、Mg2+、NO3-
科目:高中化学 来源:2016届湖北省高三9月调考化学试卷(解析版) 题型:填空题
(10分)粉煤灰中含有SiO2、Al2O3、Fe2O3等,某实验室对其进行处理的流程如下图所示:

回答下列问题:
(1)第①步得到的“熟料”中可溶性的成分主要是NH4Fe(SO4)2、NH4Al(SO4)2等,写出生成NH4Fe(SO4)2的化学方程式_____________。
(2)滤渣B的主要成分与NaOH溶液反应的离子方程式为________。
(3)步骤③中用NH4HCO3调节pH的实验原理为__________(用离子方程式表示)。
(4)实验室进行第④步操作时,所需的仪器是酒精灯、石棉网、三脚架、玻璃棒、_________,得到的晶体主要成份是_________(填化学式)。第⑥步生成Al(OH)3的离子方程式为_________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高一上10月月考化学试卷(解析版) 题型:选择题
下列有关实验的做法不正确的是
A.分液操作时分液漏斗中下层液体从下口放出,上层液体从上口倒出
B.容量瓶使用前需要检查是否漏水
C.配置0.1000 mol·L—1氯化钠溶液时,将液体转移到容量瓶中需用玻璃棒引流
D.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
查看答案和解析>>
科目:高中化学 来源:2016届贵州省高三上学期第二次月考理综化学试卷(解析版) 题型:填空题
纯碱一直以来都是工业生产的重要原料,很长一段时间来纯碱的制法都被欧美国家所垄断。上个世纪初我国著名的工业化学家侯德榜先生,经过数年的反复研究终于发明了优于欧美制碱技术的联合制碱法(又称侯氏制碱法)。并在天津建造了我国独立研发的第一家制碱厂。其制碱原理的流程如图所示:
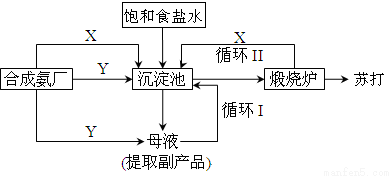
(1)侯德榜选择天津作为制碱厂的厂址有何便利条件(举二例说明)_____________、______________。
(2)侯氏制碱法的最终产物是(化学式)_______________;其在水溶液中显著的实质是(离子方程式):__________________。
(3)合成氨工厂需要向制碱厂提供两种原料气体,它们分别是:______________、_____________。这两种气体在使用过程中是否需要考虑添加的顺序?____________(填“是”或“否”),原因是_______________。
(4)在沉淀池中发生的反应的化学方程式是_________________。
(5)使原料水中溶质的利用率从70%提高到90%以上,主要是设计了_____________(填上述流程中的编号)的循环.从母液中可以提取的副产品的应用是______________(举一例)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省济南外国语学校高三上学期期中测试化学试卷(解析版) 题型:选择题
在体积可变的密闭容器中,反应mA(g)+nB(g) pC(g)达到平衡后,压强容器的体积,发现A的转化率随之降低,下列说法中,正确的是
pC(g)达到平衡后,压强容器的体积,发现A的转化率随之降低,下列说法中,正确的是
A.m+n必定小于p B.m+n必定大于p
C.m必定小于p D.m必定大于p
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三上10月阶段质检化学试卷(解析版) 题型:填空题
(16分)碳、氮及其化合物在工农业生产生活中有着重要作用。请回答下列问题:
(1)用CH4 催化还原NOx 可以消除氮氧化物的污染。例如:
CH4(g)+ 4NO2(g)=4NO(g)+CO2(g)+ 2H2O(g) ΔH1=-574 kJ·molˉ1
CH4(g)+ 4NO(g)= 2N2(g)+CO2(g)+ 2H2O(g) ΔH2
若2 mol CH4 还原NO2 至N2,整个过程中放出的热量为1734 kJ,则ΔH2= ;
(2)据报道,科学家在一定条件下利用Fe2O3与甲烷反应可制取“纳米级”的金属铁。其反应为:Fe2O3(s)+ 3CH4(g) 2Fe(s)+ 3CO(g)+6H2(g) ΔH>0
2Fe(s)+ 3CO(g)+6H2(g) ΔH>0
①若反应在5L的密闭容器中进行,1min后达到平衡,测得Fe2O3在反应中质量减少3.2g。则该段时间内CO的平均反应速率为________________。
②若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是____________
a.CH4的转化率等于CO的产率
b.混合气体的平均相对分子质量不变
c.v(CO)与v(H2)的比值不变
d.固体的总质量不变
③该反应达到平衡时某物理量随温度变化如图所示,当温度由T1升高到T2时,平衡常数KA KB(填“>”、“<”或“=”)。纵坐标可以表示的物理量有哪些 。

a.H2的逆反应速率
b.CH4的的体积分数
c.混合气体的平均相对分子质量
d.CO的体积分数
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解50ml2mol/L的氯化铜溶液的装置示意图:
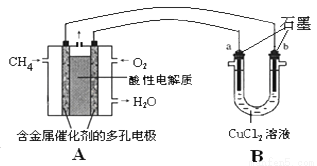
请回答:
①甲烷燃料电池的负极反应式是:__________________________。
②当A中消耗0.05mol氧气时,B中________________极(填“a”或“b”)增重________________g。
(4)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递H+)实现氨的电化学合成,从而大大提高了氮气和氢气的转化率。电化学合成氨过程的总反应式为:N2+3H2 2NH3,该过程中还原反应的方程式为 。
2NH3,该过程中还原反应的方程式为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南洛阳高级中学高二上9月月考化学试卷(解析版) 题型:选择题
汽车尾气中,产生NO的反应为:N2(g)+O2(g) 2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化。下列叙述正确的是:
2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化。下列叙述正确的是:
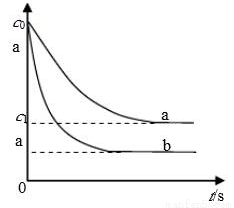
A.曲线b对应的条件改变可能是加入了催化剂
B.温度T下,随着反应的进行,混合气体的密度减小
C.温度T下,该反应的平衡常数K=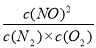
D.若曲线b对应的条件改变是温度,可判断该反应的△H<0
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期10月月考化学试卷(解析版) 题型:选择题
往含等物质的量的偏铝酸钠溶液与氢氧化钠的混合溶液中通入二氧化碳,产生沉淀的量与通入二氧化碳的量关系正确的是
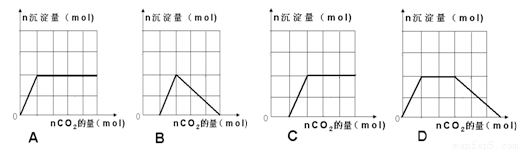
查看答案和解析>>
科目:高中化学 来源:2016届福建省莆田市高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列各反应的离子方程式中,错误的是
A.硫酸铝溶液中加入过量的氨水:Al3++3NH3·H2O===Al(OH)3↓+3NH4+
B.铁片放入过量的稀硝酸中:3Fe+8H++2NO3-===3Fe2++2NO2↑+4H2O
C.将铝片放入过量NaOH溶液中:2Al+2OH-+2H2O===2AlO2-+3H2↑
D.偏铝酸钠与过量盐酸反应:AlO2-+4H+===Al3++2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com