
 2NaOH + H2↑ + Cl2↑~2e—,则CH4~8e—~8NaOH溶液的体积为1L, pH为12,则NaOH物质的量为0.01mol,所以则理论上消耗甲烷在标准状况下的体积为0.01mol/8·22.4L·10-3="28" mL;
2NaOH + H2↑ + Cl2↑~2e—,则CH4~8e—~8NaOH溶液的体积为1L, pH为12,则NaOH物质的量为0.01mol,所以则理论上消耗甲烷在标准状况下的体积为0.01mol/8·22.4L·10-3="28" mL;

科目:高中化学 来源:不详 题型:单选题
| A.反应物的总能量高于生成物的总能量时,发生放热反应 |
| B.燃煤发电是直接把化学能转化为电能 |
| C.需要加热才能进行的化学反应不一定是吸热反应 |
| D.化学反应过程中的能量变化,服从能量守恒定律 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.(6a+5d-4c-12b)kJ·mol-1 |
| B.(4c+12b-6a-5d)kJ·mol-1 |
| C.(4c+12b-4a-5d)kJ·mol-1 |
| D.(4a+5d-4c-12b)kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.稀HCl和稀NaOH |
| B.1.0 mol·L-1 HCl和1.0 mol·L –1 NaOH |
| C.500 mL 2.0 mol·L-1 HCl和500 mL2.0 mol·L –1 NaOH |
| D.500 mL 2.0 mol·L-1 H2SO4和500 mL 2.0 mol·L-1 Ba(OH)2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①② | B.③ | C.④ | D.均不符合 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
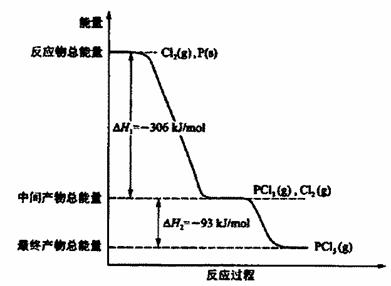
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.C(s)+O2(g)===CO2(g)△H1 C(s)+1/2O2(g)===CO(g)△H2 |
| B.H2(g)+1/2O2(g)===H2O(l)△H1 2H2(g)+O2(g)===2H2O(l)△H2 |
| C.S(g)+O2(g)===SO2(g)△H1S(s)+O2(g)===SO2(g)△H2 |
| D.CaCO3(s)===CaO(s)+CO2(g) △H1 CaO(s)+H2O(l)===Ca(OH)2(s) △H2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②⑥⑦ | B.②⑤⑦⑧ | C.②③⑦⑧ | D.③④⑤⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com