
| A. | 该物质在水中的溶解度大 | |
| B. | 该物质的水溶液导电能力强 | |
| C. | 该物质的水溶液中不存在溶质分子 | |
| D. | 该物质的水溶液中不存在除水外的电离平衡 |
分析 完全电离的电解质为强电解质,强酸、强碱和大部分的盐、金属氧化物等都是强电解质.
解答 解:A、易溶于水的物质不一定是强电解质,如醋酸,即电解质的强弱与溶解度无关,故A错误;
B、水溶液能导电能力强的物质不一定是强电解质,如醋酸为弱电解质,导电能力强于硫酸钡(微溶,溶解部分完全电离),即导电能力与电解质强弱无关,故B错误;
C、该物质的水溶液中不存在溶质分子,说明完全电离,是强电解质,故C正确;
D、该物质的水溶液中不存在除水外的电离平衡,说明完全电离,故D正确,故选CD.
点评 本题考查了强电解质的判断,根据电解质的电离程度划分强弱电解质,与溶液的导电性、是否挥发、物质的溶解性等都无关,为易错点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 将含0.1molFeCl3的溶液滴加到沸水中完全水解可生成0.1NA个Fe(OH)3胶粒 | |
| B. | 常温常压下,0.1molD216O中含中子数、质子数、电子数均为NA | |
| C. | 将0.1molCl2通入1L水中,转移的电子数为0.1NA | |
| D. | 电解饱和食盐水,当阴极产生1.12LH2时,转移的电子数一定为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
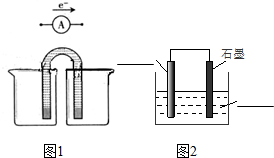
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在Na2CO3溶液中:c(OH-)-c(H+)═c(HCO3-)+c(H2CO3) | |
| B. | 在pH=8的NaB溶液中:c(Na+)-c(B-)=9.9×10-7 mol/L | |
| C. | 浓度均为0.1 mol/L的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)═c(HCO3-)+c(H2CO3) | |
| D. | 向10mL pH=12的NaOH溶液中滴加pH=2的HA溶液达中性:则混合液体积V总≥20mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
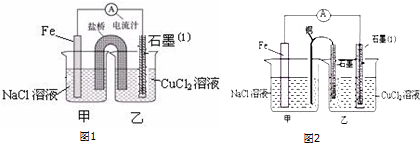
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
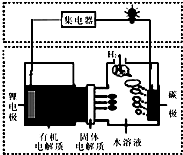
| A. | 碳极发生的反应是:2H2O+O2+4e-═4OH- | |
| B. | 有机电解质通过固体电解质可进入水溶液中 | |
| C. | 理论上,外电路中每转移1mol电子,负极消耗的质量为7g | |
| D. | 该电池如可以充电,充电时碳极接外加电源的负极,锂极接外加电池的正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石比石墨稳定 | |
| B. | 1 mol石墨所具有的能量比1 mol金刚石低 | |
| C. | 金刚石转变成石墨是物理变化 | |
| D. | 石墨和金刚石都是碳的同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
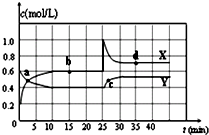 在恒温条件下将一定量X和Y的混合气体通入一容积为2L的密闭容器中,X和Y两物质的浓度随时间变化情况如图.
在恒温条件下将一定量X和Y的混合气体通入一容积为2L的密闭容器中,X和Y两物质的浓度随时间变化情况如图.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com