
铅蓄电池的示意图如右图所示。下列说法正确的是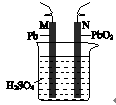
| A.放电时,N为负极,其电极反应式为: PbO2+SO42-+4H++2e-=PbSO4+2H2O |
| B.放电时,c(H2SO4)不变,两极的质量增加 |
| C.充电时,阳极反应式为:PbSO4+2e-= Pb+SO42- |
| D.充电时,若N连电源正极,则该极生成PbO2 |
科目:高中化学 来源: 题型:
(Ⅰ)(7分)
甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源。
(1)101 kPa时,1 mol CH3OH完全燃烧生成稳定的氧化物放出热量726.51 kJ/mol,
则甲醇燃烧的热化学方程式为 。
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H1=+49.0 kJ·mol-1
②CH3OH(g)+O2(g)= CO2(g)+2H2(g) △H2
已知H2(g)+O2(g)===H2O(g) △H =-241.8 kJ·mol-1
则反应②的△H2= kJ·mol-1。
(3)甲醇燃料电池的结构示意图如右。甲醇进入 极(填“正”或“负”),写出正极的电极反应式
(Ⅱ)(5分)
铅蓄电池是典型的可充型电池,它的正负极隔板是惰性材料,电池总反应式为:
Pb+PbO2+4H++2SO42- 2PbSO4+2H2O,请回答下列问题(不考虑氢、氧的氧化还原):
(1)放电时:正极的电极反应式是
电解液中H2SO4的浓度将变 ;
(2)在完全放电耗尽PbO2和Pb时,若按右图连接,电解一段时间后,则在A电极上生成 B电极上生成
查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建师大附中高二上学期期末考试化学试卷 题型:单选题
(Ⅰ)(7分)
甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源。
(1)101 kPa时,1 mol CH3OH完全燃烧生成稳定的氧化物放出热量726.51 kJ/mol,
则甲醇燃烧的热化学方程式为 。
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H1="+49.0" kJ·mol-1
②CH3OH(g)+ O2(g)= CO2(g)+2H2(g) △H2
O2(g)= CO2(g)+2H2(g) △H2
已知H2(g)+ O2(g)===H2O(g) △H ="-241.8" kJ·mol-1
O2(g)===H2O(g) △H ="-241.8" kJ·mol-1
则反应②的△H2= kJ·mol-1。
(3)甲醇燃料电池的结构示意图如右。甲醇进入 极(填“正”或“负”),写出正极的电极反应式 
(Ⅱ)(5分)
铅蓄电池是典型的可充型电池,它的正负极隔板是惰性材料,电池总反应式为:
Pb+PbO2+4H++2SO42- 2PbSO4+2H2O,请回答下列问题(不考虑氢、氧的氧化还原):
2PbSO4+2H2O,请回答下列问题(不考虑氢、氧的氧化还原): 
(1)放电时:正极的电极反应式是
电解液中H2SO4的浓度将变 ;
(2)在完全放电耗尽PbO2和Pb时,若按右图连接,电解一段时间后,则在A电极上生成 B电极上生成
查看答案和解析>>
科目:高中化学 来源:2012-2013学年甘肃省高三第四次检测化学试卷(解析版) 题型:选择题
铅蓄电池的示意图如右图所示。下列说法正确的是
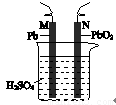
A.放电时,N为负极,其电极反应式为: PbO2+SO42-+4H++2e-=PbSO4+2H2O
B.放电时,c(H2SO4)不变,两极的质量增加
C.充电时,阳极反应式为:PbSO4+2e-= Pb+SO42-
D.充电时,若N连电源正极,则该极生成PbO2
查看答案和解析>>
科目:高中化学 来源:2013届福建师大附中高二上学期期末考试化学试卷 题型:选择题
(Ⅰ)(7分)
甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源。
(1)101 kPa时,1 mol CH3OH完全燃烧生成稳定的氧化物放出热量726.51 kJ/mol,
则甲醇燃烧的热化学方程式为 。
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H1=+49.0 kJ·mol-1
②CH3OH(g)+ O2(g)= CO2(g)+2H2(g) △H2
O2(g)= CO2(g)+2H2(g) △H2
已知H2(g)+ O2(g)===H2O(g) △H =-241.8 kJ·mol-1
O2(g)===H2O(g) △H =-241.8 kJ·mol-1
则反应②的△H2= kJ·mol-1。
(3)甲醇燃料电池的结构示意图如右。甲醇进入 极(填“正”或“负”),写出正极的电极反应式

(Ⅱ)(5分)
铅蓄电池是典型的可充型电池,它的正负极隔板是惰性材料,电池总反应式为:
Pb+PbO2+4H++2SO42-  2PbSO4+2H2O,请回答下列问题(不考虑氢、氧的氧化还原):
2PbSO4+2H2O,请回答下列问题(不考虑氢、氧的氧化还原): 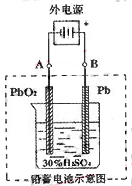
(1)放电时:正极的电极反应式是
电解液中H2SO4的浓度将变 ;
(2)在完全放电耗尽PbO2和Pb时,若按右图连接,电解一段时间后,则在A电极上生成 B电极上生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com